
- •I.Типы химических связей
- •II.Ковалентная связь
- •III. Механизм цепных радикальных реакций
- •Алкены CnH2n
- •Диеновые углеводороды
- •3) Методы введения тройной связи.
- •Циклические углеводороды
- •Ароматические соединения
- •1)Понятие
- •2)Бензойдные и небензойдные
- •3)Электрофильное замещение
- •1(Водородная связь)
- •2(Амфотерность спиртов)
- •3(Сходство и различие спиртов и фенолов)
- •1) Строение карбоксильной группы. Кислотность карбоновых кислот
- •2) Способы синтеза карбоновых кислот
- •3) Реакции, подтверждающие кислый характер карбоновых кислот
- •1)Типы производных карбоновых кислот и методы их синтеза
- •2) Реакции гидролиза карбоновых кислот
- •3) Жиры
- •1) Строение карбонильной группы
- •2) Реакции присоединения по карбонильной группе
- •3) Реакции окисления и восстановления карбонильных соединений
- •3(Амины как нуклеофилы)
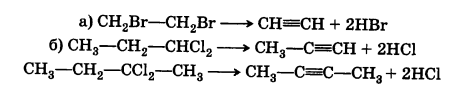
3) Методы введения тройной связи.
Наиболее
общий способ получения является действие
спиртового р-ра щелочей на дигалогенпроизводные
предельных углеводородов с вицинальным(а)
или геминальным(б) расположением атомов
галогена:
Высокотемпературный
крекинг. Ацетилен
можно получить высокотемп.крекинге(термическом
или электротермическом) метана или
более сложных углеводородов:![]()
Циклические углеводороды
1) Виды
Алициклические - углеводороды, в которых углеродные цепи образуют циклы, не обладающие ароматическим характером.(не содержат бензольного кольца)
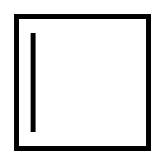
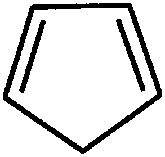
Циклобутен циклопентадиен
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.(содержат бензольное кольцо)
2)Типы напряжения
Торсионное-взаимодействие связей в заслоненной комформаии.
Ван –Дер –Вальса Отталкивание взаимных заместителей близкое сумме радиусов.
Угловое отклонение валентных углов между с-с в цикле.Кресло –нет напряжение.
Ароматические соединения
1)Понятие
Склонны к реакции замещения при этом ненасыщенные.Бензол насыщенный все связи в одной плоскости . Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. 4n+2
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом.Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6), но в отличие от углеводородов ряда этилена C2H4 проявляет свойства, присущие насыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
2)Бензойдные и небензойдные
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения. Среди небензоидных ароматических соединений хорошо известны азулен, аннулены, гетарены (пиридин, пиррол, фуран, тиофен), ферроцен. Бензойдные с изолированными ядрами (дифенилметан,полистирол).С конденсированными (нафталин,пирен)Арены.
3)Электрофильное замещение
Электрофильное замещение (SE) – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. Примеры электрофильных частиц: Cl+, Br+, NO2+, CH3+, CH3CH2+ и т.п. Катионы типа CH3+, Cl+ существуют в составе комплексов CH3+[AlCl4]- и Cl+[FeCl3]-.
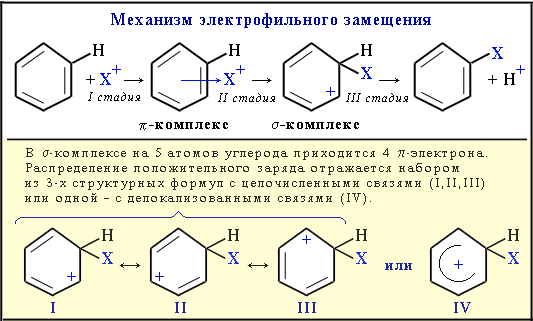
I стадия: образование p-комплекса, в котором электрофильная частица Х+притягивается к p-электронному облаку бензольного кольца.
II стадия (лимитирующая): образование s-комплекса. Два электрона изp-системы идут на образование s-связи С–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2- в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 p-электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1).
III стадия: отщепление протона Н+ и восстановление ароматичности кольца, поскольку два электрона разрывающейся связи С–Н переходят в p-систему кольца.
Влияние заместителей на скорость SE
1) Электронодонорные заместители (D) повышают электронную плотность кольца и увеличивают скорость реакции SE(активирующие заместители): -NH2, -OH, -OR, -NHR, -NR2, -NH-C(O)R,алкильные группы
2) Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции SE(дезактивирующие заместители): -NO2, -CF3, -SO3H, -NR3, -CN
Спирты и фенолы
