- •I.Типы химических связей
- •II.Ковалентная связь
- •III. Механизм цепных радикальных реакций
- •Алкены CnH2n
- •Диеновые углеводороды
- •3) Методы введения тройной связи.
- •Циклические углеводороды
- •Ароматические соединения
- •1)Понятие
- •2)Бензойдные и небензойдные
- •3)Электрофильное замещение
- •1(Водородная связь)
- •2(Амфотерность спиртов)
- •3(Сходство и различие спиртов и фенолов)
- •1) Строение карбоксильной группы. Кислотность карбоновых кислот
- •2) Способы синтеза карбоновых кислот
- •3) Реакции, подтверждающие кислый характер карбоновых кислот
- •1)Типы производных карбоновых кислот и методы их синтеза
- •2) Реакции гидролиза карбоновых кислот
- •3) Жиры
- •1) Строение карбонильной группы
- •2) Реакции присоединения по карбонильной группе
- •3) Реакции окисления и восстановления карбонильных соединений
- •3(Амины как нуклеофилы)
Диеновые углеводороды
1(Типы диеновых углеводородов)
Диеновые углеводороды – это углеводороды с двумя двойными связями.
Общая формула диеновых углеводородов: СnН2n-2.
Алкадиены, в молекулах которых две двойных связи разделены одной простой связью, называются соединениями с сопряженными двойными связями (дивинил и его гомологи).
СН2=СН-СН =СН2 бутадиен-1,3 (дивинил).
Алкадиены, в молекулах которых две двойных связи примыкают к одному углеродному атому, называются углеводородами с кумулированными двойными связями (аллен и его гомологи):
СН2=С=СН2 пропадиен-1,2 (аллен);
R-СН =С=СН2 алкилаллены.
Углеводороды, в молекулах которых две двойных связи разделены двумя и более простыми связями, называются алкадиенами с изолированными двойными связями.
СН2=СН—СН2—СН=СН2 пентадиен-1,4.
Химические свойства диеновых углеводородов.
Имея двойные связи в молекулах, диеновые углеводороды вступают в обычные реакции присоединения.
Например: а) обесцвечивают бромную воду; б) присоединяют галогеноводороды.
3(Реакция 1,4 и 1,2 присоединения)
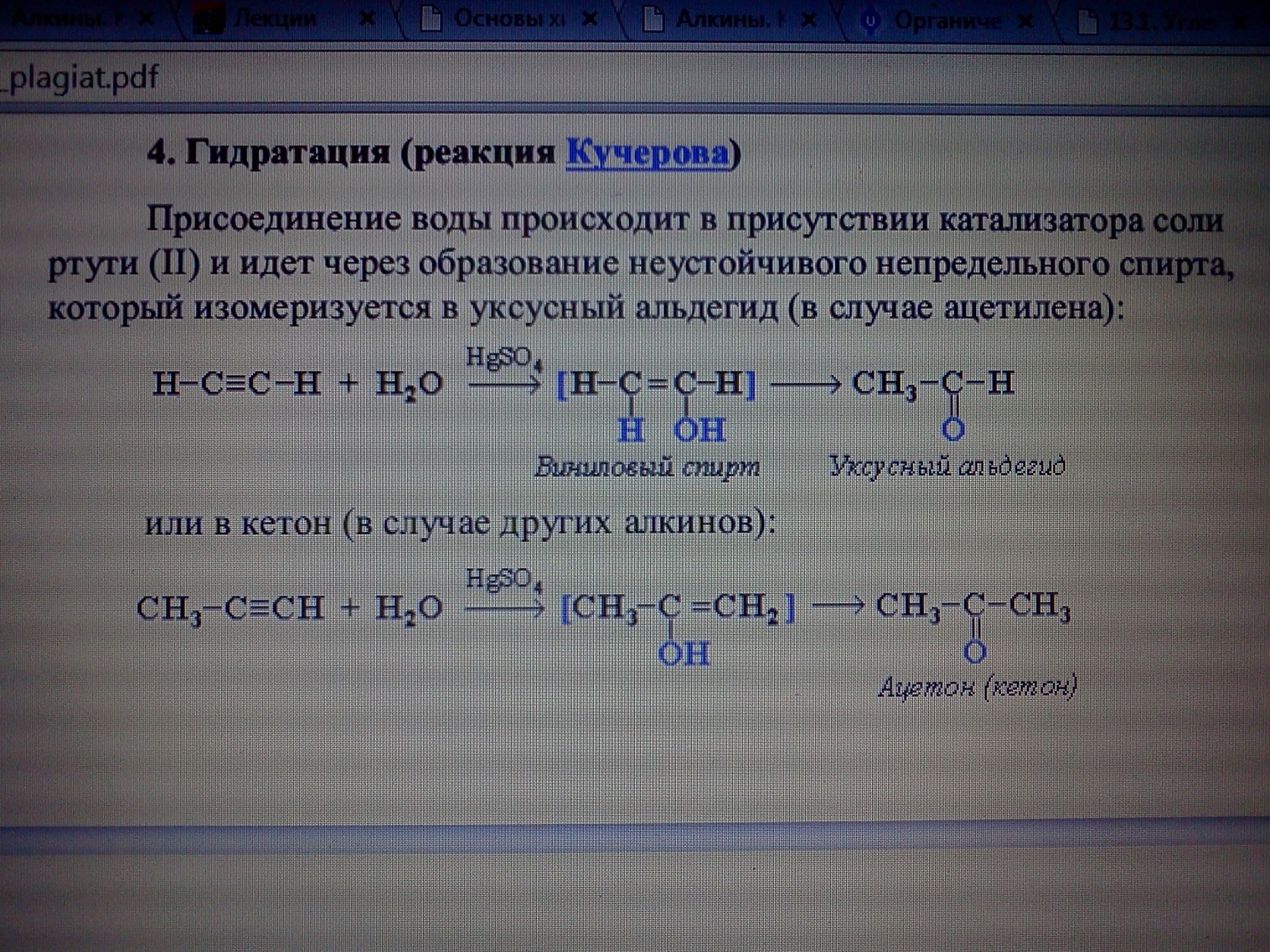
Характерной особенностью реакции присоединения является то, что наряду с обычным 1,2-присоединением идет 1,4-присоединение, при этом между 2-м и 3-м углеродными атомами возникает двойная связь. При реакции бутадиена-1,3 с бромистым водородом получается два продукта:
2(Строение п связи в сопряженных диенах)
1,3-Диены отличаются рядом особенностей в своем
химическом поведении, которое обусловлено их электронным строением.
CH2CHCHCH2
В молекуле бутадиена-1,3 между атомами углерода имеются три σ-связи,
образованные sр2-электронами, и две π-связи, образованные четырьмя р-
электронам. При этом происходит перекрывание всех четырех р-орбиталей, т.е образуется единое облако р-электронов, которое находится в плоскости,
перпендикулярной плоскости σ-связей. Это взаимодействие двух π-связей
получило название эффекта сопряжения.
В этом случае отдельные пары π-электронов не закреплены за определенными связями, а распределены (делокализованы) по всей молекуле. р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя
общую π-электронную систему. Такой особый вид взаимного влияния атомов
называется сопряжением.
Сопряжение - это образование в молекуле единого делокализованного
электронного облака в результате перекрывания негибридизованных p-орбиталей. Возможно два типа сопряжения:
а) π,π-сопряжение - делокализованные МО могут принадлежать двум или более
π-связям.
б) р,π- сопряжение-в сопряжении могут участвовать π-связи и соседний атом с р-орбиталью.
Сопряжение приводит к тому, что в молекуле другие длины связей (стремление к выравниванию). Молекулы с делокализованными связями имеют по сравнению с молекулами с изолированными связями, энергию.
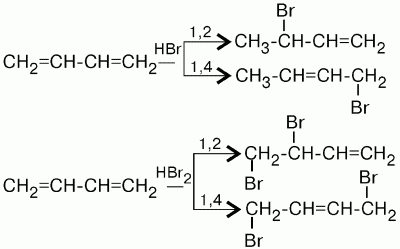
4(Мономеры для каучуков)
Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является природный каучук.
Алкины
1 Кислотность
Особенность
электронного строения алкинов —
повышенная полярность ацетиленовой
связи С—Н. Она обусловлена следующими
причинами. Известно, что 2s-электроны в
среднем Расположены ближе к ядру, чем
2p-электроны:
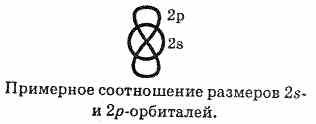
Орбитали ацетиленового атома углерода (sp-гибридные орбитали) содержат значительно больший вклад p-характера, чем sp3-и sp2-орбитали. Это приводит к увеличению электронной плотности вблизи атома углерода. Если такой атом образует за счет sp-орбитали связь, то в ней, соответственно, электронная плотность сдвинута в сторону атома углерода (по сравнению с такой же связью, образованной sp3-гибридизованным атомом). Иными словами можно сказать, что у sp-гибридизованного атома углерода электроотрицательность выше, чем у sp3- и sp2-гибридизованных атомов. Соответственно, у алкинов с тройной связью на конце цепи (терминальных алкинов) соответствующая связь С-Н более полярна, чем в алкенах и алканах, и имеет слабокислотный характер.
в
терминальных алкинах (с тройной связью
на конце цепи) концевой атом водорода
проявляет слабокислотные свойства.
Соответственно такие алкины могут
вступать в реакции с сильными основаниями
и образовывать соли — ацетилениды:
![]() (ацетиленид динатрия)
(ацетиленид динатрия)
![]() (ацетиленид
калия)
(ацетиленид
калия)
2