
- •I.Типы химических связей
- •II.Ковалентная связь
- •III. Механизм цепных радикальных реакций
- •Алкены CnH2n
- •Диеновые углеводороды
- •3) Методы введения тройной связи.
- •Циклические углеводороды
- •Ароматические соединения
- •1)Понятие
- •2)Бензойдные и небензойдные
- •3)Электрофильное замещение
- •1(Водородная связь)
- •2(Амфотерность спиртов)
- •3(Сходство и различие спиртов и фенолов)
- •1) Строение карбоксильной группы. Кислотность карбоновых кислот
- •2) Способы синтеза карбоновых кислот
- •3) Реакции, подтверждающие кислый характер карбоновых кислот
- •1)Типы производных карбоновых кислот и методы их синтеза
- •2) Реакции гидролиза карбоновых кислот
- •3) Жиры
- •1) Строение карбонильной группы
- •2) Реакции присоединения по карбонильной группе
- •3) Реакции окисления и восстановления карбонильных соединений
- •3(Амины как нуклеофилы)
I.Типы химических связей
Ионная связь (электровалентная, гетерополярная). Возникает между атомами, сильно отличающимися по электроотрицательности. Не имеет определенного направления в пространстве, т.к. электрическое поле ионов одинаково и симметрично во всех направлениях. Отличительные черты соединений с ионной связью: мгновенность протекания реакций, диссоциация ионов в водных растворах, высокие температуры кипения и плавления, растворимость в полярных растворителях.
Ковалентная связь (гомеополярная). Образуется за счет обобществления электронов. Обладает высокой прочностью. Энергия зависит от степени перекрывания между атомными орбиталями. Имеет направленность в пространстве. Неполярная ковалентная связь – между атомами с одинаковой электроотрицательностью. Полярная ковалентная связь – между атомами с разной электроотрицательностью.
II.Ковалентная связь
1.Виды гибридизации атома углерода
Близкие по энергии и имеющие общие элементы симметрии молекулярные орбитали могут взаимодействовать между собой, образуя гибридные орбитали с более низкой энергией.
При взаимодействии
s-орбитали с
 -орбиталью
образуются две sp-гибридизированные
орбитали, имеющиеся, например, у атомов
углерода в ацетилене. Такой тип гибридизции
называется sp-гибридизацией
(или диагональной гибридизацией).
-орбиталью
образуются две sp-гибридизированные
орбитали, имеющиеся, например, у атомов
углерода в ацетилене. Такой тип гибридизции
называется sp-гибридизацией
(или диагональной гибридизацией).
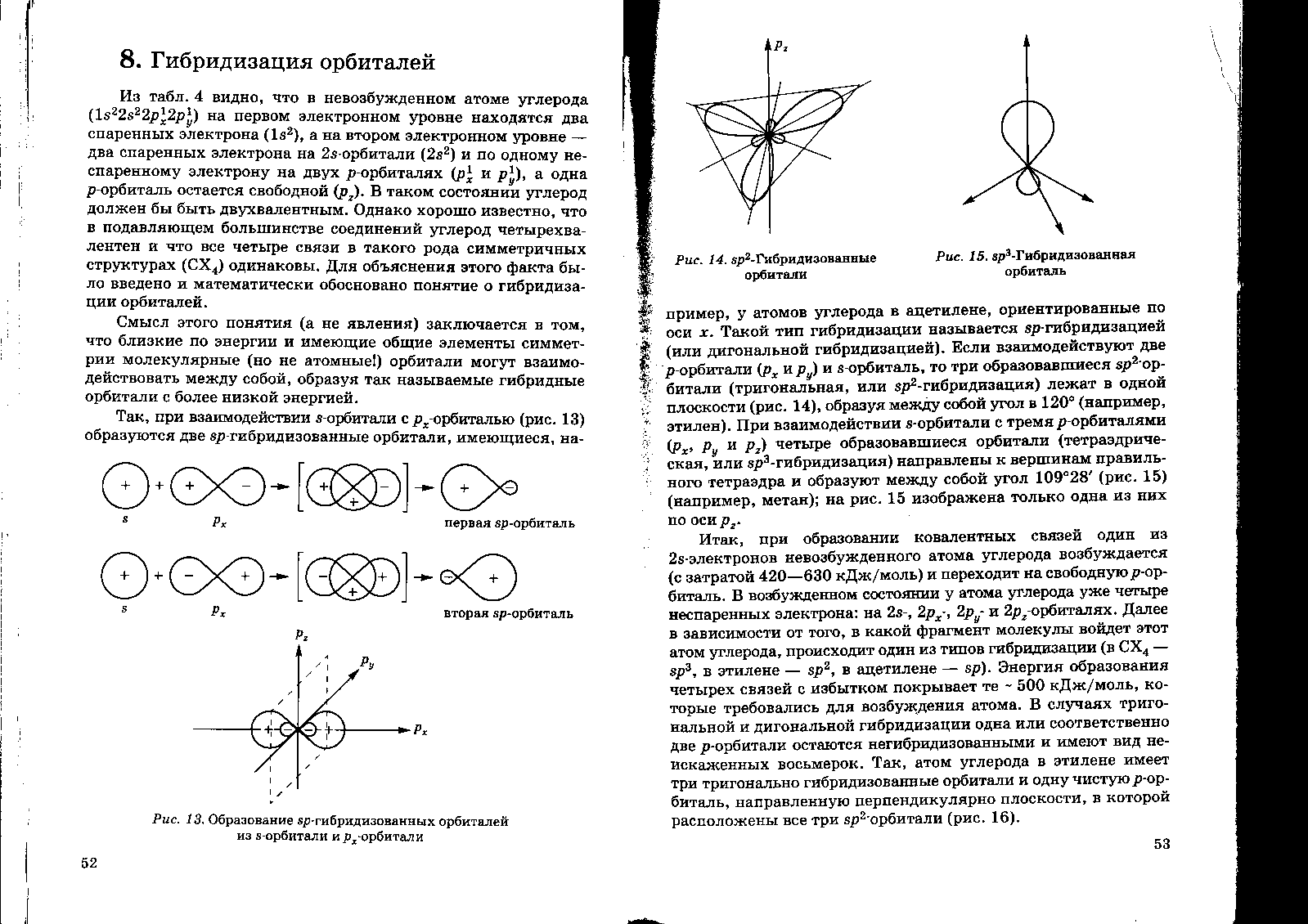
Если взаимодействует
две p-орбитали ( )
и s-орбиталь, то три
образовавшиеся
)
и s-орбиталь, то три
образовавшиеся
 орбитали
(тригональная или
-гибридизация)
лежат в одной плоскости, образуя между
собой угол в 120 градусов (например,
этилен).
орбитали
(тригональная или
-гибридизация)
лежат в одной плоскости, образуя между
собой угол в 120 градусов (например,
этилен).
При взаимодействии
s-орбитали с тремя
p-орбиталями(
 )
четыре образовавшиеся орбитали
(тетраэдрическая, или
)
четыре образовавшиеся орбитали
(тетраэдрическая, или
 -гибридизация)
направлены к вершинам правильного
тетраэдра и образуют между собой угол
-гибридизация)
направлены к вершинам правильного
тетраэдра и образуют между собой угол
 (например, метан).
(например, метан).
2.Понятие орбитали,
способы перекрывания орбиталей:
 -
и
-
и
 -
связи, циклические орбитали (ароматические
соединения)
-
связи, циклические орбитали (ароматические
соединения)
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Образовавшуюся орбиталь называют сигма (σ )-орбиталью, а связь – σ -связью, если перекрывание орбиталей осуществляется вдоль оси связывания атомов. Так, например, при образовании связей с атомами водорода в метане четыре sp3-гибридных орбитали атома углерода перекрываются с 1s- орбиталями четырёх атомов водорода, образуя четыре одинаковых прочных σ –связи под углом 109°28´ (тетраэдрический угол).
При перекрывании атомных орбиталей вне оси связывания атомов образуется так называемая π-молекулярная орбиталь, а связи называются π - связями. Образуется при взаимодействии двух p-орбиталей соседних атомов. В этом случае возникает две области максимальной электронной плотности условно выше и ниже оси связи. Поэтому π-связь менее прочна и ее электроны могут значительно легче смещаться в сторону одного из атомов.
Циклические орбитали (на примере бензола). Шесть атомов углерода, связанные друг с другом σ-связями одинаковой длины образуют правильный шестиугольник, причем все 6 атомов углерода расположены в одной плоскости. Атомы углерода находятся в -гибридизации. В результате сопряжения р-электронов р-орбиталей шести атомов углерода образуется единое π-электронное облако, расположенное над и под кольцом. Эти электроны не связаны с каким-либо одним атомом углерода и могут перемещаться относительно них. Это обусловливает особую устойчивость бензола.
3.Свойства ковалентной связи: энергия связи, полярность связи, направленность в пространстве (примеры)
Энергия связи. Энергия связи – энергия, которую необходимо затратить, чтобы разорвать химическую связь между атомами. Если элементы имеют высокую или низкую электроотрицательность, связи непрочные (F-F, Na-Na). Если связь образована неодинаковыми атомами, то чем больше разница в электроотрицательности, тем связь прочнее(H-F). Энергия связи зависит от природы заместителей, находящихся у связанных атомов.
Полярность связи. Ковалентная связь между двумя одинаковыми атомами является неполярной, в том случае, если электронная плотность распределена равномерно между ядрами атомов, образующих связь. Например, С-С связи в молекулах этана, этилена, бензола являются ковалентными неполярными связями.
Если ковалентная связь образована атомами с разной электроотрицательностью, то электроны связи сдвинуты к атому, имеющему большее еёзначение. В этом случае связь является ковалентной полярной (H-Cl).
Направленность связи. Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков. Формы молекул: линейная (НСl, H2, Cl2), угловая (Н2О, Н2S), пирамидальная (NH3, PH3), треугольная (BCI3, AICI3), тетраэдрическая (CCI4, CH4).
4.Гомолитический и гетеролитический разрыв ковалентной связи (на примерах)
Любая простая (одинарная) связь образована парой электронов. При разрыве связи двухатомной молекулы может реализоваться ситуация, когда у каждого из атомов остается по одному электрону – такой разрыв связи называется гомолитическим. При этом образуются свободные радикалы.
H – Cl

При изменении условий реакции или характера связи связь может рваться так, что оба электрона останутся у одного из атомов – это гетеролитический разрыв связи. Это способ, обратный образованию ковалентной связи по донорно-акцепторному механизму.
H – O
– H

