
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Явище ізомерії, ізомери
Префікс ізо- означає «однаковий».
Явище ізомерії – це явище існування речовин з однаковим якісним і кількісним складом, але різною будовою та властивостями.
Ізомери – це сполуки, що мають однакову молекулярну формулу, але різну будову і властивості.
Для насичених вуглеводнів характерний лише один вид ізомерії: розгалуження карбонового (вуглецевого) ланцюга.
Молекула метану СН4 – змінити даний ланцюг не можна, оскільки в молекулі є лише один атом Карбону.
Формула етану С2Н6, структурна формула якого СН3-СН3, також не можна змінити карбоновий ланцюг.
Формула пропану С3Н8, структурна формула – СН3-СН2-СН3. Якщо умовно закрити один атом Карбону, то залишиться два атома, а третій атом опустити від першого або від другого атома Карбону:
 СН2
СН3
СН3
СН2
СН2
СН3
СН3
СН2
СН3 СН3
Т аким чином можна групи СН3 можна розвернути і одержати лінійну формулу СН3-СН2-СН3.

 СН2
СН3
СН3
СН2
СН2
СН3
СН3
СН2
 СН3
СН3
СН3
СН3
СН3-СН2-СН3 СН3-СН2-СН3
Отже, не можна радикали ставити до першого та до останнього атомів Карбону, оскільки можна одержати лінійну формулу.
Тому ізомерія насичених вуглеводнів починається з бутану:
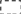
С труктурна
формула: СН3-СН2-СН2-СН3
труктурна
формула: СН3-СН2-СН2-СН3


І зомер:
СН3
СН СН3
зомер:
СН3
СН СН3
СН3
Правила називання ізомерів
Вибрати найдовший ланцюг і починати нумерувати потрібно з того боку, де ближче знаходиться радикал.
1 2 3
СН3 СН СН3
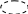 СН3
СН3
2. Вказати номер атома Карбону біля якого знаходиться радикал.
1 2 3
СН3 СН СН3
СН3
2-
3. Дати назву радикалу.
1 2 3
СН3 СН СН3
СН3
2-метил
4. Дати назву основному карбоновому ланцюгу.
1 2 3
СН3 СН СН3
СН3
2-метилпропан
Якщо радикалів декілька, то:
а) два
однакових радикала записується префікс
ди-
і
називається р адикал,
наприклад:
адикал,
наприклад:
1
2 3 4 5
 СН3
СН СН2
СН СН3
СН3
СН СН2
СН СН3
СН3 СН3
2,4-диметилпентан
б) три однакових – префікс три- і назва радикала, наприклад:
1 2 3 4 5
СН3 СН СН СН СН3
СН3 СН3 СН3
2,3,4-триметилпентан
в
1
2 3 4 5 6
 СН3
СН
СН СН
СН
СН3
СН3
СН
СН СН
СН
СН3
СН3 СН3 СН3 СН3
2,3,4,5-тетраметилгексан
г) кілька неоднакових радикала – записують за алфавітним порядком, наприклад:
1 2 3 4 5 6 7 8
СН3 СН СН2 СН СН2 СН СН2 СН3
СН3 С2Н5 СН3
4-етил-2,6-диметилоктан
Написання формул ізомерів за їх назвами
Наприклад: 2,2-диметилбутан.
1) записувати формулу потрібно починати з основного ланцюга (в даному прикладі – це бутан): С-С-С-С;
1 2 3 4
2) пронумерувати атоми Карбону: С-С-С-С;
3) додати радикали до відповідних атомів Карбону:
1 2 3 4
 С
С С С
С
С С С
СН3
4) додати до кожного атома Карбону таку кількість атомів водню, щоб Карбон був чотиривалентним:
1
2 3 4
СН3 С СН2 СН3
СН3
