
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Завдання для самоконтролю
1. Які були погляди віталістів на добування органічних речовин?
2. Які вчені експериментально довели помилковість поглядів віталістів? Коротко охарактеризуйте відкриття цих вчених.
Що називається органічною хімією?
4. Який елемент становить основу складу органічних сполук?
Які елементи, крім Карбону, входять до складу органічних речовин?
Чому, на вашу думку, кількість органічних речовин значно перевищує кількість неорганічних речовин?
Чим відрізняються неорганічні та органічні речовини?
Заповнити таблицю відмінних ознак неорганічних та органічних речовин:
-
Відмінності
Неорганічні речовини
Органічні речовини
Кількість речовин
Валентність
Хімічні зв’язки
Кристалічні решітки
Розчинність у воді
Хімічні властивості (швидкість реакцій)
Насичені вуглеводні Поняття та класифікація вуглеводнів
Вуглеводні – це органічні речовини, що складаються із двох елементів Карбону та Гідрогену.
 Вуглеводні
Вуглеводні
насичені ненасичені
Насичені вуглеводні – це сполуки Карбону та Гідрогену, у молекулах яких між атомами Карбонів існують прості одинарні зв’язки (-С-С-С-).
Насичені вуглеводні ще називають алканами або парафінами.
Алкани – назва насичених вуглеводнів за міжнародною номенклатурою.
Парафіни – історична назва насичених вуглеводнів (від лат. parrum affinis – малоактивний).
§2. Метан Склад і будова молекули
Найпростішою органічною сполукою, до складу якої входять лише один атом Карбону і чотири атоми Гідрогену, є метан. Його молекулярна формула СН4.
Атом Карбону в стані спокою на зовнішньому енергетичному рівні має два спарених s-електрона і два неспарених р-електрона.
s
-
6С
1


р
2
У органічних речовинах атом Карбону знаходиться у збудженому стані. У результаті надходження енергії в атомі Карбону розпаровуються s-електрони на зовнішньому енергетичному рівні і утворюється чотири неспарених електрона, з яких 1s- і 3р-електрона.
s s
-
6С
1

р
6С
1
р
2
2
Таким чином, атом Карбону у збудженому стані має валентність чотири. До кожного неспареного електрона атома Карбону підходять із своїм одним електроном атоми Гідрогену:
s
-
6С
1
р
Н
Н
2
∙∙





Н
:
С
:
Н
Н

С
Н
∙∙
Н
Н
Н
Н
Н
Н
електронна структурна
формула формула
s-електронні хмари мають шароподібну форму, а р-електронні хмари - гантелеподібну форму. Прийнято, що при утворенні хімічних зв’язків електронні хмари набувають однакової форми.
![]()



1s 3р sр3
Явище зміни форми різних електронних орбіталей одного атома з утворенням однакових електронних орбіталей, називається явищем гібридизації.
У молекулі метану чотири sр3-гібридні орбіталі взаємно відштовхуючись, розміщуються в просторі так, що їх осі направлені до вершин тетраедра.
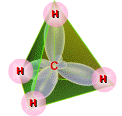
При такому розміщенні орбіталі максимально віддалені одна від одної. Щоб перекриття кожної з цих орбіталей із s-орбіталлю атома Гідрогену було найбільш ефективним і утворювався найбільш міцний зв’язок, необхідно, щоб ядро кожного атома Гідрогену розміщувалися у вершинах цього тетраедра. Валентний кут чотирьох зв’язків атома Карбону – 109,5о.
Р
Н

Н
Н
масштабна модель будови
кулестержнева модель будови молекули метану
молекули метану
