
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Завдання для самоконтролю
88. Які вуглеводні відносяться до циклічних сполук? Чому циклічні сполуки іноді називають нафтенами?
89. Складіть рівняння реакцій, при допомозі яких можна одержати: а) циклобутан із бутану; б) бутан із циклобутану; в) бензен із гексану.
90. Наведіть рівняння повного згорання циклопропану і циклогексану.
§ 15. Бензен
На ранній стадії розвитку органічної хімії ароматичними називали сполуки, які виділяли з природних запашних речовин – рослинних смол, бальзамів, ладану, ефірних масел. Деякі з них володіли приємним запахом (ванілін). Але, мабуть, жодна зі сполук не викликала такого інтересу дослідників, як бензин – ця проста за складом речовина. У подальшому було встановлено, що багато відомих ароматичних сполук є похідними бензену чи можуть бути утворені з нього. З того часу бензен, його похідні та гомологи називають ароматичними сполуками.
Термін «ароматичний» в сучасному розумінні стосується не запаху, а будови і хімічних властивостей цих речовин.
Ароматичні вуглеводні – це органічні речовини, до складу яких входять одне або декілька бензенових ядер.
Міжнародна назва ароматичних вуглеводнів – арени.
Склад і будова молекули бензену
Найпростіший серед ароматичних вуглеводнів – бензен (застаріла назва – бензол). Молекулярна формула бензену С6Н6. Хоча бензин був відкритий М. Фарадеєм у 1825 році, елементний склад сполуки було визначено лише через 20 років, а будова молекули ще впродовж 20 років становила теоретичну проблему, бо жодна з пропонованих ученими структурних формул не відповідала повною мірою властивостям речовини, які вона виявляла.
Для бензену пропонували такі структури:
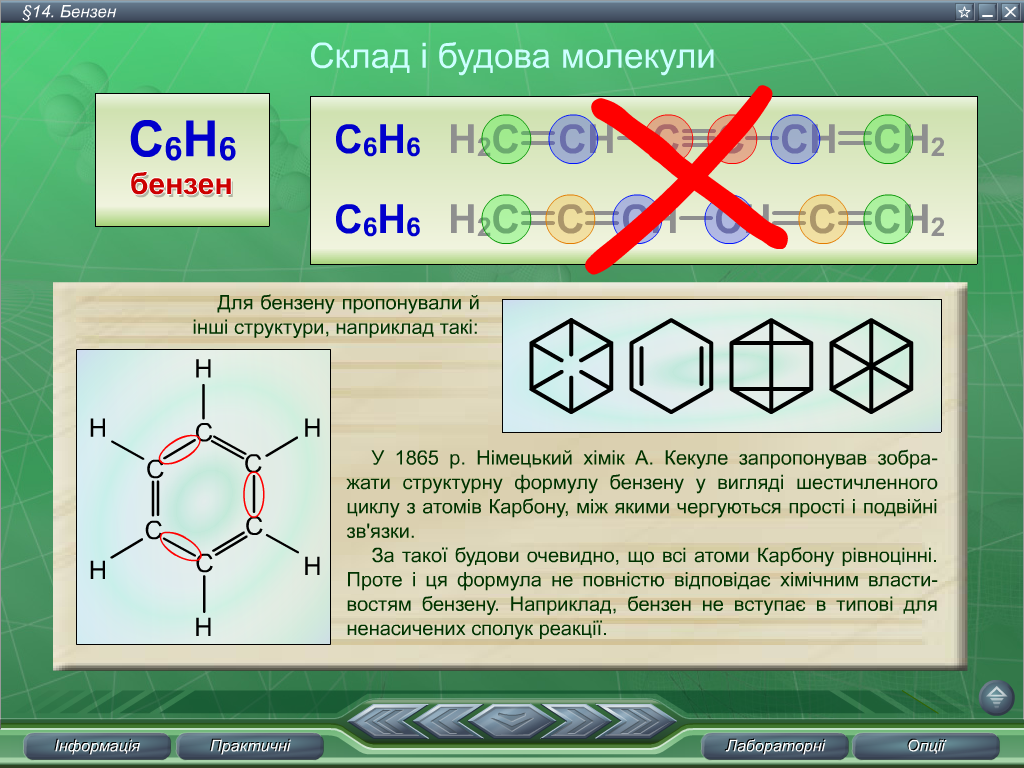
У 1865 році німецький хімік А. Кекуле запропонував зобразити структурну формулу бензену у вигляді шестичленного циклу з атомів Карбону, між якими чергуються прості й подвійні зв’язки.
За такої будови очевидно, що всі атоми Карбону рівноцінні. Проте і ця формула не повністю відповідає хімічним властивостям бензену. Наприклад, бензен не вступає в типові для ненасичених сполук реакції.
Рис.1
молекула бензену
Рис.2
негібридні р-орбіталі кожного атома
Карбону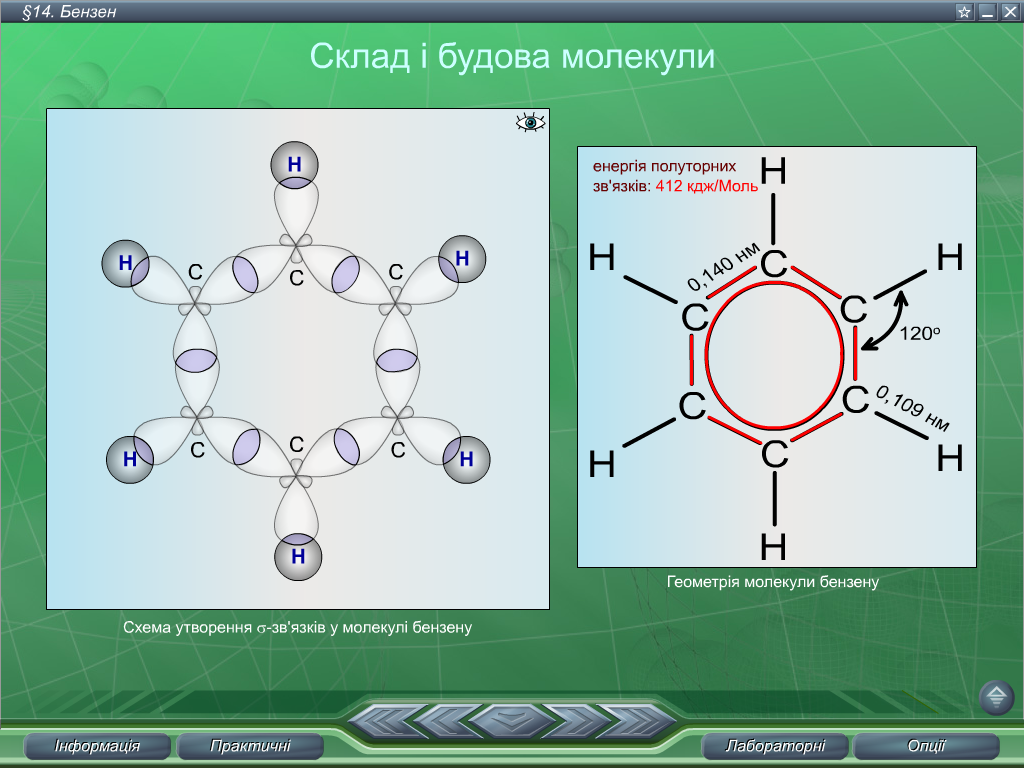 Реальну
будову бензену було пояснено на основі
електронної теорії. Згідно із сучасними
уявленнями, молекула бензену є простим
правильним шестикутником, у вершинах
якого містяться атоми Карбону (Рис.1),
що перебувають у стані sр2-гібридизації.
Всі три гібридних орбіталі, прекриваючись,
утворюють σ-зв’язки, які знаходяться
в одній площині. Дві з них перекриваються
одна з одною
Реальну
будову бензену було пояснено на основі
електронної теорії. Згідно із сучасними
уявленнями, молекула бензену є простим
правильним шестикутником, у вершинах
якого містяться атоми Карбону (Рис.1),
що перебувають у стані sр2-гібридизації.
Всі три гібридних орбіталі, прекриваючись,
утворюють σ-зв’язки, які знаходяться
в одній площині. Дві з них перекриваються
одна з одною 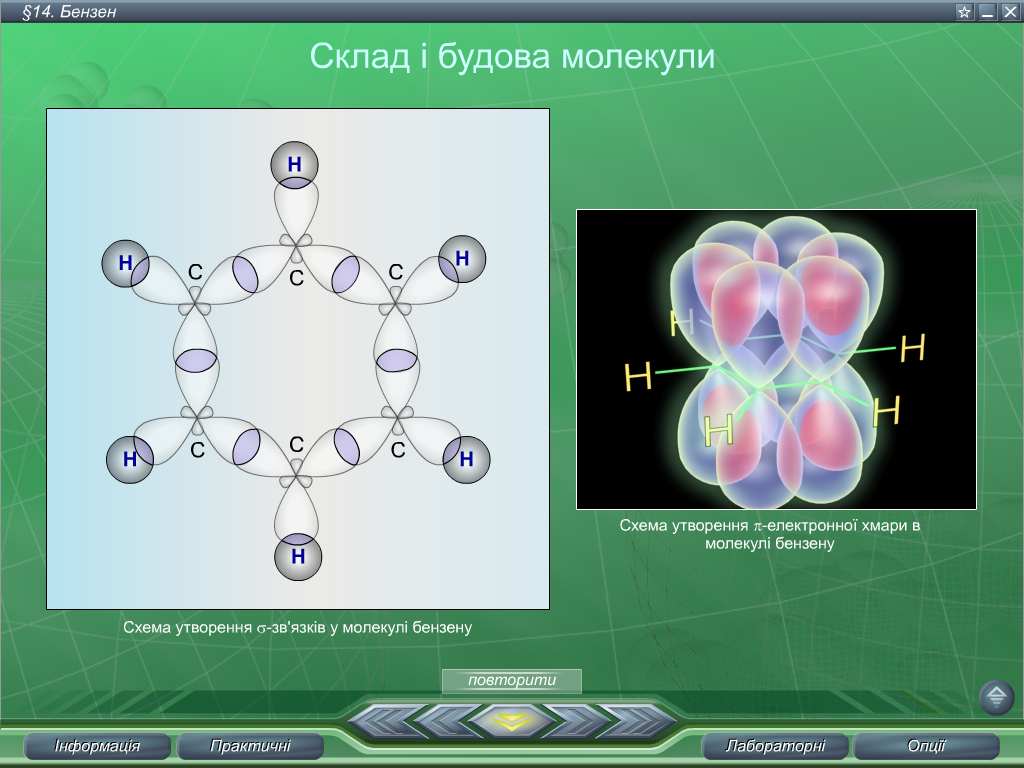 утворюються
три σ-зв’язки. Негібридні р-орбіталі
кожного атома Карбону (Рис.2), що залишилися
перекриваються над і під площиною
молекули (оскільки мають форму об’ємної
вісімки), утворюючи єдину π-молекулярну
орбіталь. Єдина π-молекулярна орбіталь
розміщена над
утворюються
три σ-зв’язки. Негібридні р-орбіталі
кожного атома Карбону (Рис.2), що залишилися
перекриваються над і під площиною
молекули (оскільки мають форму об’ємної
вісімки), утворюючи єдину π-молекулярну
орбіталь. Єдина π-молекулярна орбіталь
розміщена над
Д
 ля
зображення структурної формули молекули
бензену можна використовувати:
або
ля
зображення структурної формули молекули
бензену можна використовувати:
або
Добування бензену
Найважливішими джерелами ароматичних вуглеводнів є кам’яновугільна смола та гази, які утворюються при коксуванні вугілля і переробці нафти.
Дегідрування (відщеплення водню) циклогексану:
СН2 CН
Н2С
СН2
t, kt
+ 3Н2
Н2С СН2 НС СН
СН2 СН
циклогексан бензен
2. Дегідрування гексану:
СН2 CН
Н2С
t, kt СН3
СН3
+ 4Н2
Н2С СН3 НС СН
СН2 СН
гексан бензен
3. Полімеризація ацетилену:
С
+
НС
СН
t, kt
+ →
НС
+
СН СН
t, kt
або 3С2Н2 → С6Н6
Фізичні властивості
Бензен – безбарвна, летка, вогненебезпечна рідина з характерним запахом. Його температура кипіння 80,1 оС. При охолодженні він легко перетворюється в білу кристалічну масу з температурою плавлення 5,5 оС. У воді бензен практично не розчиняється. Горить дуже кіптявим полум’ям. Пара бензену з повітрям утворює вибухову суміш. Рідкий бензен і пара бензену отруйні. За звичайних умов більшість ароматичних вуглеводнів також являють собою безбарвні рідини, нерозчинні у воді, з характерним запахом.
Хімічні властивості
1. Горіння: (горить кіптявим полум’ям)
2С6Н6 + 15О2 → 12СО2 + 6Н2О
2. Реакції заміщення:
а)бромува
FeCl3,
t
С6Н6 + Br2 С6Н5Br + НBr
 СН
бромбензен
СН
СН
бромбензен
СН
НС
С
FeCl3,
t Н
Н
+ Br-Br + НBr
НС СН НС СН
СН СН
бензен бромбензен
б)
нітрування
H2SО4,
t
С6Н6 + НNO3 С6Н5NO2 + Н2О
нітробензен
СН СН
НС
H2SО4,
t СН
СН
+ НО-NO2 + Н2О
НС СН НС СН
СН СН
бензен нітробензен
в)
повне хл
AlCl3
С6Н6 + 6Cl2 С6Н6Cl6 + 6НCl
гексахлорбензен
СН СCl
НС
СН
AlCl3
+ 6Сl2 + 6НCl
НС СН ClС СCl
СН СCl
бензен гексахлорбензен
3. Реакції приєднання (проходять при суворіших умовах: при високій температурі, високому тиску та відповідному каталізаторі):
а)
Гідрува
t
Ni
або
Pt
С6Н6 + 3Н2 С6Н12
бензен циклогексан
СН
 СН2
СН2
НС
СН
t
Ni
або
Pt
+ 3Н2
НС СН Н2С СН2
СН СН2
бензен циклогексан
б)
Хлоруван
hυ
С6Н6 + 3Сl2 С6Н6Cl6
бензен гексахлорциклогексан
СН СНCl
НС
СН
hυ
+ 3Cl2
НС СН ClНС СНCl
СН СНCl
бензен гексахлорциклогексан
Застосування
Бензен застосовують як хімічна сировина для виробництва ліків, пластмас, барвників, пахучих речовин, полімерів, вибухових речовин. Широко використовують як розчинник. Бензен як добавка поліпшує якість моторного палива.
