
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Хімічні властивості
1. Горіння:
2СН2=СН-СН=СН2 + 11О2 → 8СО2 + 6Н2О
1,3-бутадієн
2. Приєднання галогенів:
СН2=СН-СН=СН2 + Вr2 → СН2Вr-СН=СН-СН2Вr
1,3-бутадієн 1,4-дибром-2-бутен
При достатній кількості брому утворюється 1,2,3,4-тетрабромбутан:
СН2=СН-СН=СН2 + 2Вr2 → СН2Вr-СНВr-СНВr-СН2Вr
1,3-бутадієн 1,2,3,4-тетрабромбутан
3. Полімеризація:
t, kt
СН2=СН-СН=СН2 + СН2=СН-СН=СН2 →
→ -СН2-СН=СН-СН2-СН2-СН=СН-СН2-
або
t, kt
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n
полібутадієн
Застосування
Дієнові вуглеводні використовують для синтезу каучуків.
Завдання для самоконтролю
66. Які вуглеводні називаються дієновими?
67. Як класифікують дієнові вуглеводні?
68. Які дієнові вуглеводні називаються кумульованими, спряженими, ізольованими. Навести приклади.
69. Які хімічні властивості характерні для дієнових вуглеводнів?
70. Здійснити перетворення:
С4Н10 → С4Н8 → СН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n
§ 10. Ізомерія ненасичених вуглеводнів
Для ненасичених вуглеводнів характерні два види ізомерії:
1) розгалуження карбонового (вуглецевого) ланцюга (ізомерія починається з бутену (бутину)):
бутен
СН2=СН-СН2-СН3 (1-бутен)
СН2= С-СН3
СН3
2) зміна положення кратного зв’язку.
СН2-СН=СН-СН3 (2-бутен)
Правила називання ізомерів
1. Вибрати
найдовший ланцюг і починати нумерувати
потрібно з того боку, де ближче знаходиться
кратний зв’язок
1 2 3
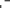 СН2=С
СН3
СН2=С
СН3
СН3
2. Вказати
номер атома Карб
1 2 3
СН2=С
СН3
СН3
2-
3. Дати назву
радикалу.
1 2 3
СН2=С
СН3
СН3
2-метил
4. Дати
назву основному кар
1 2 3
СН3=С
СН3
СН3
2-метилпропен-
5. Вказати
номер атома Карб
1 2 3
СН3=С
СН3
СН3
2-метилпропен-1
Завдання для самоконтролю
71. Написати формули речовин за назвами: 2-метил-2-бутен, 3-етил-2,2-диметил-3-гексин.
72. Знайдіть всі ізомери пентену, пентину. Дайте їм назви.
73. Знайдіть всі ізомери гексену, гексину. Дайте їм назви.
§ 11. Поняття про полімери. Поліетилен
Існує два основних способи одержання високомолекулярних сполук – полімеризація та поліконденсація.
Реакція поліконденсації – процес послідовного сполучення молекул низькомолекулярної речовини з утворенням високомолекулярної речовини з утворенням побічних продуктів (Н2О, NH3 тощо).
Реакція полімеризації – процес послідовного сполучення молекул низькомолекулярної речовини з утворенням високомолекулярної речовини без побічних продуктів.
Молекули
етилену здатні вступати в реакцію
сполучення між собою, утворюючи довгі
ланцюги з високими з
t, kt
СН2=СН2+СН2=СН2+СН2=СН2 -СН2-СН2-СН2-СН2-СН2-СН2-
або в
скор
t, kt
n СН2=СН2 (-СН2-СН2-)n
етилен поліетилен
Реакція відбувається при підвищеному тиску, високій температурі та при наявності каталізатора.
