
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Електронна будова ацетилену
Молекулярна формула етилену: С2Н2. Структурна формула: СН=СН.
При потрійному зв’язку електронна будова атома Карбону має вигляд:
|
|
s |
|
|
|
6С |
1 |
|
|
р |
|
|
2 |
|
|
|
|

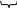 участь
у гібридизації не беруть
участь
у гібридизації не беруть
При утворенні молекули ацетилену у кожного атома Карбону гібридизуються по одному s- і р-електронній орбіталі:
1s 1р sр
У результаті цього кожний атом Карбону набуває по дві гібридних орбіталей, а два р-електронні орбіталі залишаються негібридними. Дві гібридні орбіталі (від кожного атома Карбону по одній) взаємно перекриваються, і між атомами Карбону утворюється σ-зв’язок. Інші дві гібридні орбіталі перекриваються з s-електронними орбіталями атома Гідрогену, і між ними і атомами Карбону також утворюються σ-зв’язки. Чотири (від кожного атома Карбону по дві) негібридних р-електронних орбіталей розміщені взаємно перпендикулярно і перпендикулярно напрямкам σ-зв’язкам. У цих площинах р-електронні орбіталі взаємно перекриваються і утворюються два π-зв’язка. Таким чином молекула ацетилену має лінійну будову. π-зв’язки відносно неміцні і в хімічних реакціях легко руйнуються.
Фізичні властивості ацетилену
Ацетилен – газ, без кольору, без запаху, малорозчинний у воді, трохи легший за повітря.
У природі ацетилен не зустрічається у вільному стані. Його одержують шляхом синтезу, зокрема із неорганічних речовин.
Хімічні властивості ацетилену
Для ацетилену та його гомологів характерні реакції приєднання, окиснення і полімеризації.
1. Реакції приєднання
а) взаємодія з галогенами:
СН =СН + Br2 → СНBr=СНBr
1,2-диброиетен
СНBr=СНBr + Br2 → СНBr2-СНBr2
1,1,2,2-тетраброметан
або СН =СН + 2Br2 → СНBr2-СНBr2
б)
взаємодія
t, kt
СН =СН
+ Н2
→ СН2=СН2
=СН
+ Н2
→ СН2=СН2
t, kt
СН2=СН2 + Н2 → СН3-СН3
t, kt
або СН =СН + 2Н2 → СН3-СН3
в) взаємодія з водою (реакція Кучерова):
Hg2+ О
О
СН
=СН
+ Н2О
→ CН3
С
Н
ацетальдегід або оцтовий альдегід
г) взаємодія з галогеноводнями:
СН =СН
+ НСl
→ СН2=СНСl
=СН
+ НСl
→ СН2=СНСl
хлорвініл
2. Реакції окиснення
Горіння:
2С2Н2 + 5О2 → 4СО2 + 2Н2О
Суміші ацетилену з повітрям або з киснем вибухонебезпечні. Ацетилен може також вибухати при ударах, тому його зберігають і транспортують у балонах у вигляді ацетонових розчинів, якими просочені пористі матеріали.
3. Реакції полімеризації
а) з
утворенням в
t, kt
СН =СН + СН =СН → СН =С-СН=СН2
вінілацетилен
б) з утворенням бензену:
+ С
С СН
СН
НС
СН
t, kt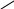
 СН
СН
 + →
+ →
НС
+
 СН
СН
СН СН
t, kt
або 3С2Н2 → С6Н6
