
- •Органічна хімія (частина перша)
- •Органічна хімія
- •§1. Поняття про органічні сполуки. Спільні та відмінні ознаки неорганічних та органічних речовин Коротка історія виникнення органічної хімії
- •Спільні ознаки неорганічних та органічних речовин
- •Відмінні ознаки неорганічних та органічних речовин
- •Класифікація органічних речовин
- •Завдання для самоконтролю
- •Насичені вуглеводні Поняття та класифікація вуглеводнів
- •§2. Метан Склад і будова молекули
- •Фізичні властивості та поширення в природі
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§3. Гомологи метану Гомологічний ряд
- •Структурні формули
- •Фізичні властивості
- •Хімічні властивості
- •Одержання насичених вуглеводнів
- •Завдання для самоконтролю
- •§4. Ізомерія насичених вуглеводнів Радикали та їх назви
- •Явище ізомерії, ізомери
- •Завдання для самоконтролю
- •§5. Теорія хімічної будови органічних речовин Виникнення теорії хімічної будови органічних речовин
- •Основні положення теорії хімічної будови органічних речовин
- •Значення теорії хімічної будови органічних речовин
- •Завдання для самоконтролю
- •§6. Визначення молекулярної формули газуватої речовини
- •Завдання для самоконтролю
- •Ненасичені вуглеводні
- •Н енасичені вуглеводні
- •§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
- •Електронна будова етилену
- •Фізичні властивості етилену
- •Хімічні властивості етилену
- •Одержання етилену
- •Застосування етилену
- •Завдання для самоконтролю
- •§ 8. Ацетиленові вуглеводні Поняття ацетиленові вуглеводні. Гомологічний ряд
- •Електронна будова ацетилену
- •Фізичні властивості ацетилену
- •Хімічні властивості ацетилену
- •Одержання ацетилену
- •Застосування ацетилену
- •Завдання для самоконтролю
- •§ 9. Дієнові вуглеводні Поняття та класифікація дієнових вуглеводнів
- •Хімічні властивості
- •Застосування
- •Завдання для самоконтролю
- •§ 10. Ізомерія ненасичених вуглеводнів
- •Завдання для самоконтролю
- •§ 11. Поняття про полімери. Поліетилен
- •С клад і будова поліетилену
- •Властивості поліетилену
- •Застосування поліетилену.
- •Завдання для самоконтролю
- •§ 12. Пластмаси
- •Завдання для самоконтролю
- •§ 13. Розв’язування розрахункових задач на виведення формули речовини за продуктами спалювання
- •Завдання для самоконтролю
- •Циклічні та ароматичні вуглеводні
- •§ 14. Циклічні сполуки
- •Гомологічний ряд та номенклатура циклічних сполук
- •Завдання для самоконтролю
- •§ 15. Бензен
- •Завдання для самоконтролю
- •§16. Поняття про хімічні засоби захисту рослин
- •Завдання для самоконтролю
- •§17. Взаємозв’язок насичених, ненасичених і ароматичних вуглеводнів
- •2 Наси чені 5
- •Завдання для самоконтролю
- •Природні джерела вуглеводнів
- •§18. Природний та супутній нафтовий гази Природний газ
- •Супутній нафтовий газ
- •Завдання для самоконтролю
- •§19. Нафта Походження нафти
- •Фізичні властивості нафти
- •Склад нафти
- •Переробка нафти
- •Крекінг нафтопродуктів
- •Детонаційна стійкість бензинів
- •Застосування нафтопродуктів
- •Завдання для самоконтролю
- •§20. Вугілля та продукти його переробки
- •Завдання для самоконтролю
Завдання для самоконтролю
39. Визначте молекулярну формулу речовини, якщо масові частки: Карбону – 84 %, Гідрогену – 16 %. Відносна густина за киснем становить 3,125. Дати назву речовині.
40. Масова частка Карбону в молекулі вуглеводню дорівнює 81,9 %. Густина речовини за повітрям 1,52. Визначте молекулярну формулу сполуки та дайте їй назву.
41. Визначте молекулярну формулу речовини, яка містить Карбону – 83,72 % і Гідрогену – 16,28 %, а молекулярна маса цієї речовини дорівнює 86 г/моль. Дайте назву цій речовині.
42. Визначте молекулярну формулу речовини, якщо масова частка Гідрогену – 16,65 %. Відносна густина за неоном становить 3,6. Дайте назву речовині.
43. Маса сполуки об’ємом 1 л – 2,59 г. Масова частка Карбону становить 82,76 %. Знайдіть молекулярну формулу. Напишіть структурні формули двох найближчих гомологів та двох ізомерів та дайте їм назви.
Ненасичені вуглеводні
Ненасичені вуглеводні – вуглеводні, в молекулах яких існують атоми Карбону, які зв’язані між собою подвійними або потрійними зв’язками.
Н енасичені вуглеводні
етиленові (-С=С-) дієнові (-С=С=С-) ацетиленові (-С=С-)
СnH2n (-ен; -єн) СnH2n-2 (-дієн) СnH2n-2 (-ин; -ін)
Етиленові вуглеводні ще називають алкенами.
Ацетиленові вуглеводні - алкінами.
Дієнові вуглеводні - алкадієнами.
§7. Етиленові вуглеводні Поняття етиленові вуглеводні. Гомологічний ряд
Етиленові вуглеводні – вуглеводні, в молекулах яких міститься один подвійний зв’язок між атомами Карбону.
Загальна формула: СnH2n.
n=1 сполуки не існує n=6 С6Н12 - гексен
n=2 С2Н4 - етен (етилен) n=7 С7Н14 - гептен
n=3 С3Н6 - пропен (пропілен) n=8 С8Н16 - октен
n=4 С4Н8 - бутен n=9 С9Н18 - нонен
n=5 С5Н10 - пентан n=10 С10Н20 - декен
Назва етиленових вуглеводнів походить від назв насичених вуглеводнів із зміною суфікса –ан на суфікс –ен або –єн.
Етиленові вуглеводні ще називають алкенами.
Електронна будова етилену
Молекулярна формула етилену: С2Н4.
Структурна формула: СН2=СН2.
При подвійному зв’язку електронна будова атома Карбону має вигляд:
-
s
6С
1
р
2
 участь
у гібридизації не бере
участь
у гібридизації не бере
У молекулі етилену піддаються гібридизації 1s- і 2р-електронні орбіталі атому Карбону.
1s 2р sр2
Таким чином кожен атом Карбону має по три (всього їх шість, оскільки у молекулі два атома Карбону) гібридних електронних орбіталей і по одній (всього два) негібридній р-орбіталі. Дві з гібридних електронних орбіталей атомів Карбону взаємно перекриваються і утворюють між атомами Карбону σ-зв’язок.
Зв’язок, утворений перекриттям електронних орбіталей, що зв’язує центри атомів горизонтально, називається σ(сігма)-зв’язком.
Решта
чотири гібридні електронні орбіталі
атомів Карбону перекриваються у тій же
площині з чотирма s-електронними
орбіталями атомів Гідрогену і також
утворюють чотири σ-зв’язка.
Гібридні орбіталі розміщуються в площині рівностороннього трикутника , тому валентні кути між ними дорівнюють 120º.

Негібридні дві р-орбіталі атомів Карбону взаємно перекриваються у площині, яка розміщена перпендикулярно площині σ-зв’язків, тобто утворюється один π-зв’язок.

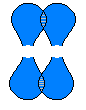
Ковалентний зв’язок, який формується при боковому перекритті негібридних р-орбіталей по два боки від лінії, що з’єднує центри атомів, називається π-зв’язок.
Отже, у молекулі етилену між атомами Карбону є один σ- і один π-зв’язки. π-зв’язок значно слабший, ніж σ-зв’язок. Під дією реагентів π-зв’язок легко руйнується.
