
- •Реакционные центры, типы реакций.
- •Основные свойства.
- •Сравнительная оценка основности аминов.
- •Кислотные свойства.
- •Сравнение кислотных свойств различных типов кислот.
- •Нуклеофильные свойства.
- •4. Для получения монобром- или мононитропроизводных анилина.
- •5. Для защиты аминогруппы в реакции алкилирования алифатических аминов с целью получения только вторичных аминов.
- •6. Биологическое значение:
- •3. Реакции аминов с эпоксидами.
- •5. Реакции конденсации аминов с альдегидами.
- •Реакции аминов с азотистой кислотой.
- •Генерирование электрофильной частицы.
- •Типы реакций аминов с азотистой кислотой.
- •Механизм реакций с катионом нитрозония.
- •Условия реакции диазотирования.
- •1. Для чего берется избыток кислоты?
- •2. Почему реакцию диазотирования проводят при охлаждении?
- •3. Почему необходимо прибавлять раствор нитрита натрия постепенно?
- •4. Почему необходимо контролировать количество азотистой кислоты при диазотировании с помощью йодкрахмальной бумаги?
- •Влияние электронодонорных и электроноакцепторных заместителей на реакционную способность ароматических аминов в реакции диазотирования.
- •Свойства солей диазония.
- •Сравнение устойчивости солей диазония.
- •I. Реакции, идущие с выделением азота.
- •Реакции диазосолей, идущих с выделением азота.
- •Примеры реакций sn1Ar
- •Реакции sr.
- •Функциональные группы.
- •Механизм реакции азосочетания sе
- •Номенклатура азосоединений.
- •1. Родоначальная структура – азобензол.
- •2. Родоначальная структура – ароматическое ядро со старшей характеристической группой.
- •3. Тривиальная номенклатура.
- •Условия азосочетания с фенолами.
- •Условия азосочетания с ароматическими аминами.
- •Значение реакции азосочетания.
Лекция 6
Азотсодержащие органические соединения:

Генетическая связь в ароматическом ряду.

Амины.
Амины – производные аммиака или гидроксида аммония, у которых один или несколько атомов водорода замещены на углеводородные радикалы.
Классификация.
I. По числу незамещенных атомов водорода при азоте.
Собственно амины – производные аммиака
|
Аммониевые основания - производные гидроксида аммония NH4OH |
|||
Амины |
Общая формула |
Название функциональной группы |
Аммониевые основания |
Общая формула |
первичные-
вторичные-
третичные |
|
амино-
имино-
нитрило- |
первичные-
вторичные-
третичные-
четвертичные |
|
Примечание: учитывается количество незамещенных атомов водорода при азоте. |
||||
II. По электронному строению радикалов.


Реакционные центры, типы реакций.

Основные свойства.
(Общие подходы к оценке основности – см. лекция 3, ч. II).
Основность аминов объясняется способностью атома азота, имеющего неподеленную пару электронов, к присоединению протона с образованием иона замещенного аммония.
Основность растворимых в воде аминов можно установить с помощью кислотно-основных индикаторов, интервал перехода окраски которых ΔрН лежит в области > 7

основание кислота сопряженная сопряженное
кислота основание
![]()
лакмус основание лакмус
красный синий
Основность нерастворимых в воде аминов можно установить реакцией образования растворимых солей с сильными минеральными кислотами:
![]()
анилин анилин солянокислый
не смешивается растворим в воде
с водой
Сравнительная оценка основности аминов.
Таблица 1.
Алифатические амины |
Ароматические амины |
||
Формула |
рКВН+ |
Формула |
рКВН+ |
|
10,6
10,7
9,8
10,7
11,2
11,3 |
|
4,6
5,1
5,2
0,4 |
Соли аминов – сильных оснований гидролитически сравнительно устойчивы, хорошо растворимы в воде, легко кристаллизируются и, как правило, более устойчивы, чем свободные основания.
Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными (реже органическими) кислотами.
Среди лекарственных препаратов есть довольно слабые основания, которые в водной среде невозможно оттитровать обычными кислотами с применением рН-индикаторов. Для количественного определения таких веществ применяется метод неводного титрования в среде уксусной кислоты, которая повышает основность. Титрант – хлорная кислота HClO4.

n-основание кислота сопряженная сопряженное
кислота основание

основание кислота сопряженная
кислота
![]()
Кислотные свойства.
(Общие подходы к оценке кислотности аминов – см. лекция 3, ч. II).
NH- кислотные свойства аминов выражены в значительно меньшей степени, чем основные. Для алифатических и ароматических аминов рКа имеют значения ~ 30-35. Амины проявляют кислотные свойства только в присутствии очень сильных оснований – металлорганических соединений, превращаясь в амиды металлов:
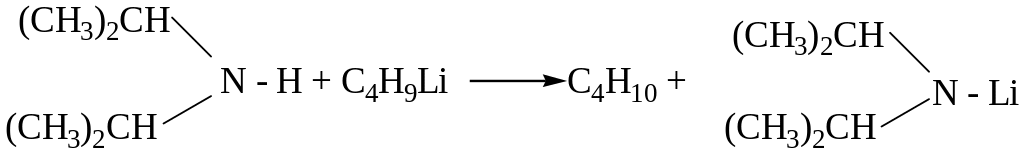
диизопропиламид лития
Амиды щелочных металлов (R2N-Na, R2N-Li) являются очень сильными основаниями и используются в органическом синтезе.




