
- •Полифункциональные производные.
- •Тиоаналоги.
- •Реакционные центры, типы реакций.
- •Генетическая связь классов органических соединений.
- •Реакции нуклеофильного замещения.
- •Механизм реакции.
- •I Стадия (медленная) – образование карбкатиона.
- •II Стадия (быстрая) – стабилизация карбкатиона.
- •Сравнение реакционной способности в реакциях sn.
- •1. Сравнение реакционной способности хлор-, бром- йодпроизводных алканов.
- •2. Сравнение реакционной способности первичных, вторичных, третичных галогеналканов (спиртов).
- •Сравнение реакционной способности винил- и аллилгалогенидов.
- •Аллилхлорид более реакционноспособен, чем винилхлорид.
- •Сравнение реакционной способности фенил- и бензилгалогенидов.
- •Причины низкой реакционной способности:
- •Бензилхлорид.
- •Сравнение реакционной способности в реакциях sn галогеналканов, спиртов, простых эфиров.
- •Реакции элиминирования (е).
- •Стереохимическая направленность реакций элиминирования (е).
- •Реакции с участием нуклеофильного центра.
- •Факторы, влияющие на степень нуклеофильности.
- •Сравнительная оценка нуклеофильность тиолов, спиртов, фенолов (нуклеофильных реагентов).
- •Примеры реакций.
- •1. Реакция межмолекулярной дегидратации.
- •3. Конкурирующая реакции – дегидрогалогенирование.
- •Примеры.
- •3. Избирательное ацилирование соединений с одновременным содержанием спиртового и фенольного гидроксилов.
- •Реакции идентификации спиртов, фенолов, простых эфиров. Химизм реакций.
- •I. Кислотные свойства – образование солей.
- •II. Образование гликолятов меди – обнаружение вицинального диольного фрагмента.
- •3. Взаимодействие со щелочами (для нерастворимых в воде он-кислот).
Реакции с участием нуклеофильного центра.
Нуклеофильность – способность атома предоставить свою электронную пару на связь с электрофильной частицей.
Факторы, влияющие на степень нуклеофильности.
Нуклеофильность увеличивается, если
- электроотрицательность уменьшается (сравниваются элементы одного периода или различно гибридизованные атомы);
- поляризуемость атомов увеличивается (сравниваются элементы одной группы);
- степень ионизации увеличивается;
- электронодонорное влияние заместителей увеличивается;
- электроакцепторное влияние уменьшается;
- используется апротонный полярный растворитель (ДМСО).
Сравнительная оценка нуклеофильность тиолов, спиртов, фенолов (нуклеофильных реагентов).

Для повышения реакционной способности реакцию катализируют либо:
- минеральными кислотами (активируется электрофильный субстрат);
- основаниями (активируется нуклеофильный реагент).
Спирты переводят в алкоголяты обработкой металлическим натрием. Фенолы обрабатывают щелочью.
О- Алкилирование.
Алкилирование – реакция введения алкильной группы в органическое соединение.
В зависимости от того, с каким атомом образуется новая связь, различают С-, О-, N-, S- алкилирование.
Алкилирующие агенты: спирты,
галогеналканы (CH3-I), диалкилсульфаты
(![]() ),
алкил- или арилсульфонаты (
),
алкил- или арилсульфонаты (![]() )
– выступают в роли электрофильного
субстрата.
)
– выступают в роли электрофильного
субстрата.
Реакции алкилирования первичных спиртов с первичными галогеналканами проходят с количественным выходом с образованием простых эфиров.
Реакция алкилирования вторичных и третичных спиртов в присутствии кислотного катализатора приводит к получению простых эфиров с более низким выходом вследствие конкурентно протекающей реакции элиминирования – дегидратации.
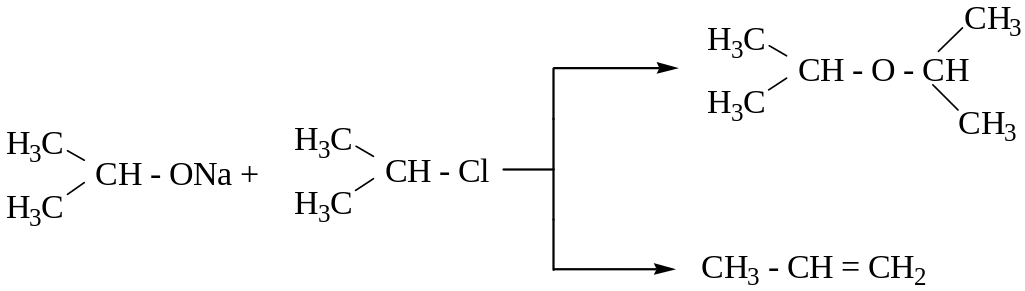
Реакция алкилирования алкоголятов вторичных и третичных спиртов с использованием вторичных или третичных галогеналканов сопровождается конкурентной реакцией дегидрогалогенирования с образованием алкена, т.к. нуклеофильность алкоголятов вторичных и третичных спиртов сопоставима с их нуклеофильностью.
Примеры реакций.
1. Реакция межмолекулярной дегидратации.
Химизм.
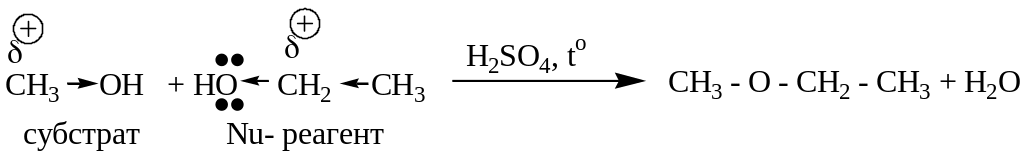
Механизм.

Конкурирующая реакция – внутримолекулярная дегидратация (при недостатке спирта).
Химизм.

Механизм.
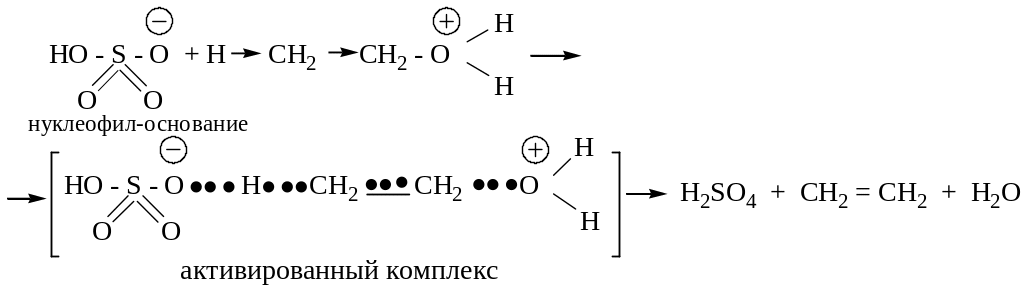
2. Реакция Вильямсона – получение простых эфиров алкилированием алкоголятов или фенолятов алкилгалогенидами.
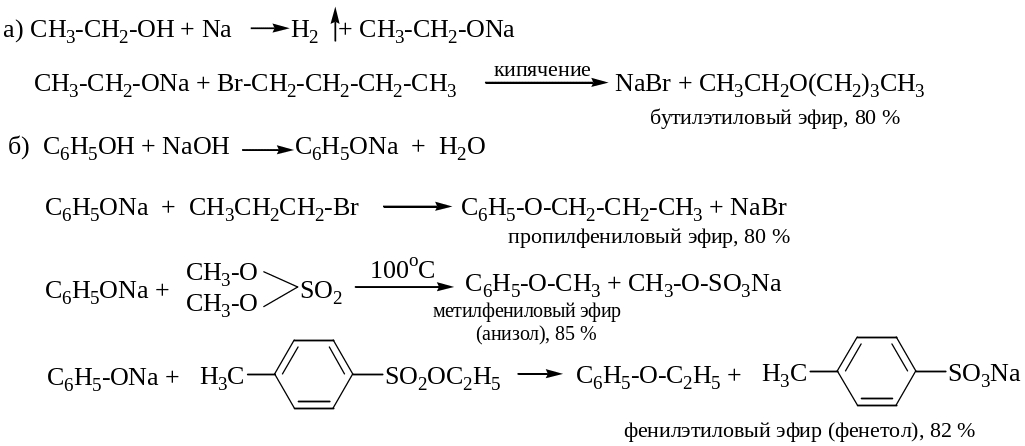
3. Конкурирующая реакции – дегидрогалогенирование.
4. Алкилирование в присутствии ДМСО (апротонный растворитель, в меньшей степени сольватирует спирт, т.к. не образует с ним водородных связей. Отсутствие сольватации повышает нуклеофильность, можно использовать спирт и щелочь вместо алкоголята.
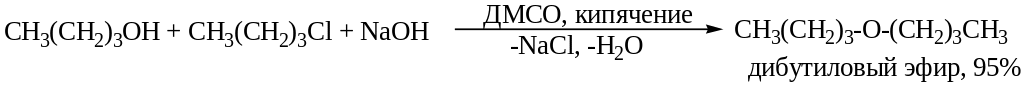
О-Ацилирование.
Ацилирование – замещение протонизированного атома водорода на ацил с образованием сложного эфира.
В зависимости от того, с каким атомом образуется новая связь, различают С-, N-, O-, S- ацилирование.
Ацилирующие агенты: H2SO4,
HNO3, HNO2, H3PO4, SO2Cl2
(сульфурил хлорид),
![]() (хлорсульфоновая
кислота), POCl3 (фосфорилхлорид),
карбоновые кислоты и их функциональные
производные – галогенангидриды,
ангидриды, сложные эфиры).
(хлорсульфоновая
кислота), POCl3 (фосфорилхлорид),
карбоновые кислоты и их функциональные
производные – галогенангидриды,
ангидриды, сложные эфиры).
