
- •Полифункциональные производные.
- •Тиоаналоги.
- •Реакционные центры, типы реакций.
- •Генетическая связь классов органических соединений.
- •Реакции нуклеофильного замещения.
- •Механизм реакции.
- •I Стадия (медленная) – образование карбкатиона.
- •II Стадия (быстрая) – стабилизация карбкатиона.
- •Сравнение реакционной способности в реакциях sn.
- •1. Сравнение реакционной способности хлор-, бром- йодпроизводных алканов.
- •2. Сравнение реакционной способности первичных, вторичных, третичных галогеналканов (спиртов).
- •Сравнение реакционной способности винил- и аллилгалогенидов.
- •Аллилхлорид более реакционноспособен, чем винилхлорид.
- •Сравнение реакционной способности фенил- и бензилгалогенидов.
- •Причины низкой реакционной способности:
- •Бензилхлорид.
- •Сравнение реакционной способности в реакциях sn галогеналканов, спиртов, простых эфиров.
- •Реакции элиминирования (е).
- •Стереохимическая направленность реакций элиминирования (е).
- •Реакции с участием нуклеофильного центра.
- •Факторы, влияющие на степень нуклеофильности.
- •Сравнительная оценка нуклеофильность тиолов, спиртов, фенолов (нуклеофильных реагентов).
- •Примеры реакций.
- •1. Реакция межмолекулярной дегидратации.
- •3. Конкурирующая реакции – дегидрогалогенирование.
- •Примеры.
- •3. Избирательное ацилирование соединений с одновременным содержанием спиртового и фенольного гидроксилов.
- •Реакции идентификации спиртов, фенолов, простых эфиров. Химизм реакций.
- •I. Кислотные свойства – образование солей.
- •II. Образование гликолятов меди – обнаружение вицинального диольного фрагмента.
- •3. Взаимодействие со щелочами (для нерастворимых в воде он-кислот).
Сравнение реакционной способности в реакциях sn галогеналканов, спиртов, простых эфиров.
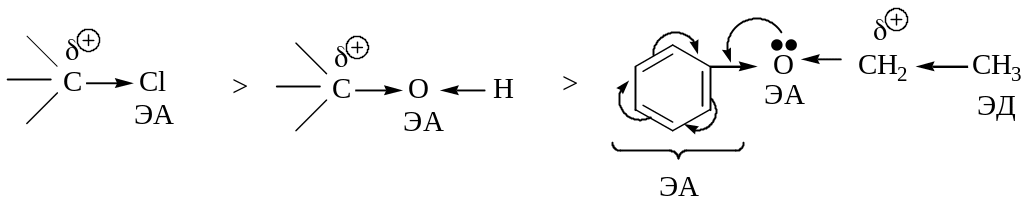
Различие в реакционной способности определяется:
- степенью электрофильности реакционного центра;
- стабильностью уходящей группы (нуклеофуга).
![]() (стабильность)
(стабильность)
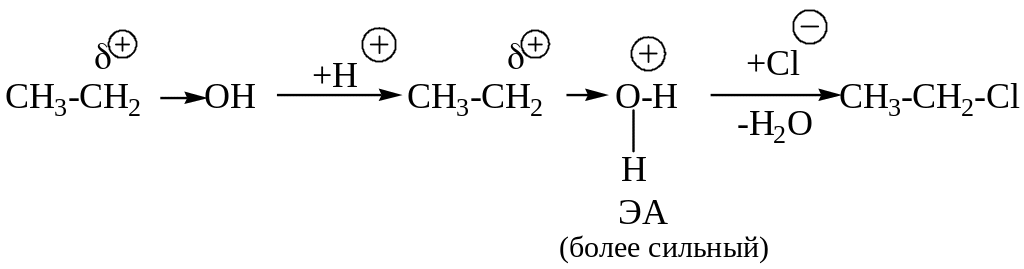
Повысить реакционную способность спиртов можно, используя кислотный катализатор, роль которого состоит в:
- усилении электроноакцепторного действия протонированного атома кислорода;
- формировании хорошей уходящей группы.
Повысить реакционную способность простых эфиров можно, используя концентрированные минеральные кислоты H2SO4, HCl, HBr HI, анионы которых являются сильными нуклеофилами.
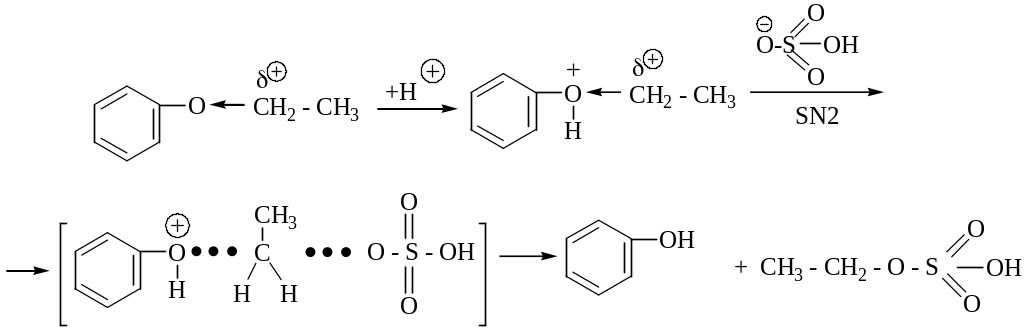
активированный комплекс
Реакция используется для идентификации жирно-ароматических простых эфиров по образовавшемуся фенолу (проба с FeCl3).
Вывод: простые эфиры не гидролизуются ни в кислой, ни в щелочной среде.
Реакции элиминирования (е).
Реакция Е1 – двухстадийная мономолекулярная реакция элиминирования, идущая через образование карбкатиона.
Реакция Е2 – одностадийная бимолекулярная реакция, идущая через образование активированного комплекса (переходное состояние). Скорость реакции зависит от концентрации субстрата и реагента.
Реакции элиминирования проходят с участием электрофильного и β-СН-кислотного центров, подчиняются правилу Зайцева: в большинстве реакций дегидрогалогенирования (отщепление галогеноводорода от галогеналканов) и дегидратации (отщепление воды от спиртов) атом водорода отщепляется преимущественно от соседнего наименее гидрогенизированного атома углерода с образованием наиболее термодинамически стабильного более замещенного алкена.
Реакции элиминирования могут идти по правилу Гофмана: в реакции элиминирования в качестве основного продукта образуется наименее замещенный алкен, если:
возникают пространственные затруднения,
- связанные с размером нуклеофила – основания;
- связанные с объемными заместителями в субстрате или в образующемся алкене;
2) если более гидрированный β-СН-кислотный центр связан с ЭА-заместителем.
Механизм реакции Е1:
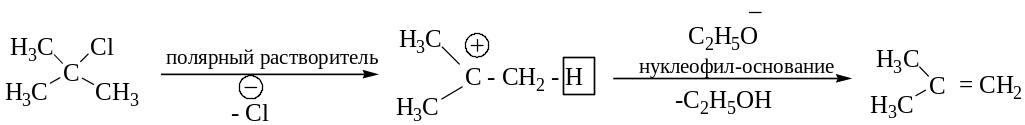
Механизм реакции Е2:

Реакции SN и Е являются конкурирующими, т.к. они осуществляются для одних и тех же субстратов и под влиянием одних и тех же реагентов.
Подбирая реагенты с большей нуклеофильностью и меньшей основностью или наоборот, можно направить реакцию по пути SN или по пути элиминирования.
Примеры:
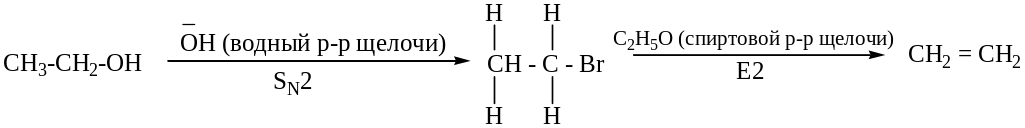
Стереохимическая направленность реакций элиминирования (е).
Реакции элиминирования сопровождаются преимущественным образованием транс-изомера, так как он:
- образуется из наиболее устойчивой заторможенной трансоидной конформации;
- термодинамически более устойчивый вследствие меньшего отталкивания заместителей, находящихся в наиболее удаленном положении.
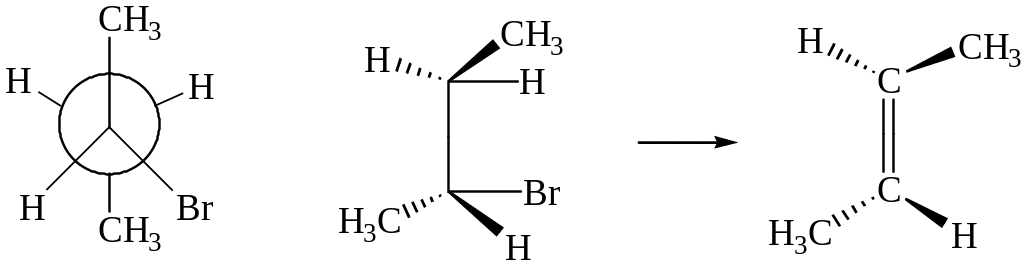
транс-бутен-2
