
- •Полифункциональные производные.
- •Тиоаналоги.
- •Реакционные центры, типы реакций.
- •Генетическая связь классов органических соединений.
- •Реакции нуклеофильного замещения.
- •Механизм реакции.
- •I Стадия (медленная) – образование карбкатиона.
- •II Стадия (быстрая) – стабилизация карбкатиона.
- •Сравнение реакционной способности в реакциях sn.
- •1. Сравнение реакционной способности хлор-, бром- йодпроизводных алканов.
- •2. Сравнение реакционной способности первичных, вторичных, третичных галогеналканов (спиртов).
- •Сравнение реакционной способности винил- и аллилгалогенидов.
- •Аллилхлорид более реакционноспособен, чем винилхлорид.
- •Сравнение реакционной способности фенил- и бензилгалогенидов.
- •Причины низкой реакционной способности:
- •Бензилхлорид.
- •Сравнение реакционной способности в реакциях sn галогеналканов, спиртов, простых эфиров.
- •Реакции элиминирования (е).
- •Стереохимическая направленность реакций элиминирования (е).
- •Реакции с участием нуклеофильного центра.
- •Факторы, влияющие на степень нуклеофильности.
- •Сравнительная оценка нуклеофильность тиолов, спиртов, фенолов (нуклеофильных реагентов).
- •Примеры реакций.
- •1. Реакция межмолекулярной дегидратации.
- •3. Конкурирующая реакции – дегидрогалогенирование.
- •Примеры.
- •3. Избирательное ацилирование соединений с одновременным содержанием спиртового и фенольного гидроксилов.
- •Реакции идентификации спиртов, фенолов, простых эфиров. Химизм реакций.
- •I. Кислотные свойства – образование солей.
- •II. Образование гликолятов меди – обнаружение вицинального диольного фрагмента.
- •3. Взаимодействие со щелочами (для нерастворимых в воде он-кислот).
Сравнение реакционной способности в реакциях sn.
Реакционную способность в реакциях SN определяют следующие факторы:
- электронодефицитность реакционного центра субстрата;
- полярность связи С – О;
- поляризуемость связи С – Х;
- стабильность интермедиата;
- стабильность нуклеофуга.
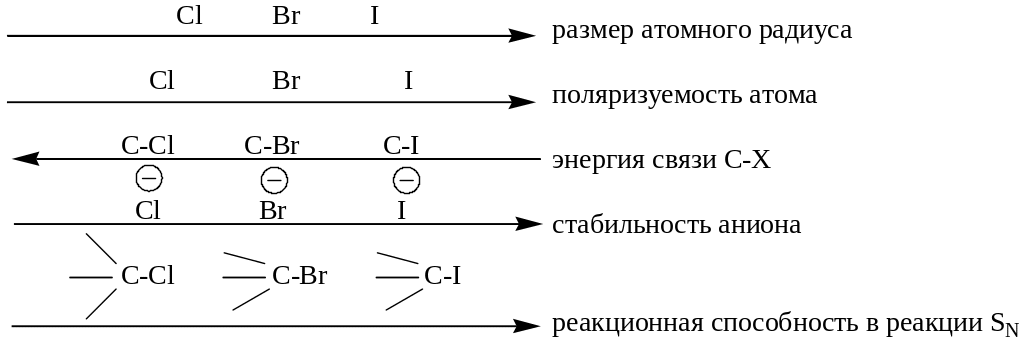
1. Сравнение реакционной способности хлор-, бром- йодпроизводных алканов.
Поляризуемость атома галогена является определяющим фактором, обусловливающим:
- уменьшение связи С – Х;
- стабильность галогенид – аниона вследствие делокализации отрицательного заряда в большом объеме.
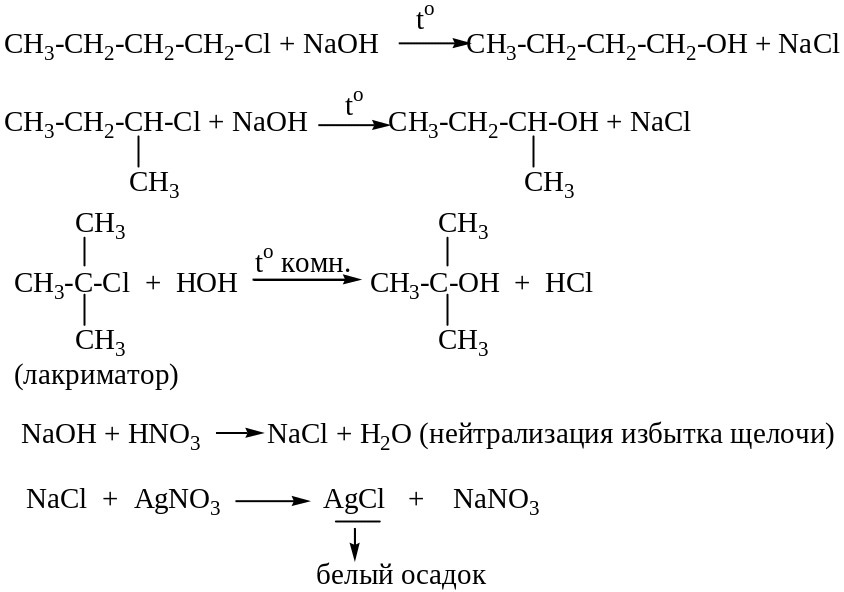
2. Сравнение реакционной способности первичных, вторичных, третичных галогеналканов (спиртов).

На различной реакционной способности первичных, вторичных и третичных галогеналканов основано их отличие с использованием реакции гидролиза.
На различной реакционной способности первичных, вторичных, третичных спиртов основано их отличие пробой Лукаса (реактив ZnCl2 + конц. HCl).
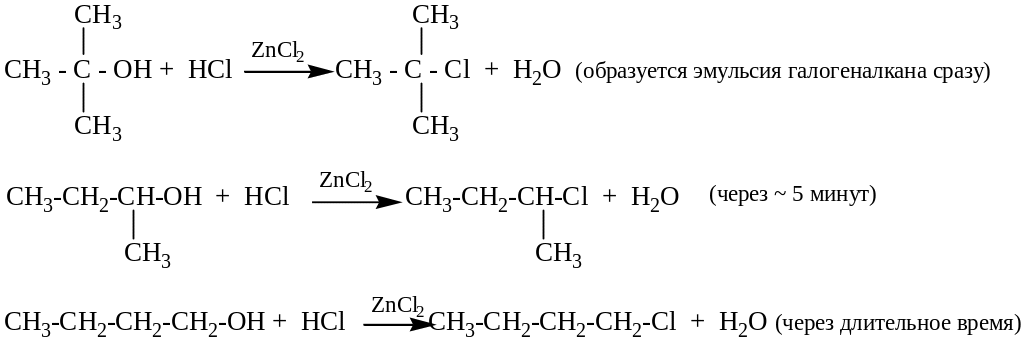
Сравнение реакционной способности винил- и аллилгалогенидов.
![]()
Винилхлорид – трехцентровая р,π-сопряженная система с делокализованным π-электронным облаком с пониженной электронодефицитностью реакционного центра; связь С-Cl укорочена, т.к. имеет характер двоесвязанности, что обусловливает ее большую прочность (статические факторы).
Протеканию реакции по SN2 механизму препятствует π-облако, экранирующее атом углерода и препятствующее подходу нуклеофила с тыла. SN1 механизм также маловероятен из-за прочности связи C- Cl и нестабильности гипотетического карбкатиона, в котором невозможна делокализация положительного заряда с участием р-орбитали двойной связи (вакантная sp2-гибридная орбиталь и р-орбиталь находятся в разных плоскостях).
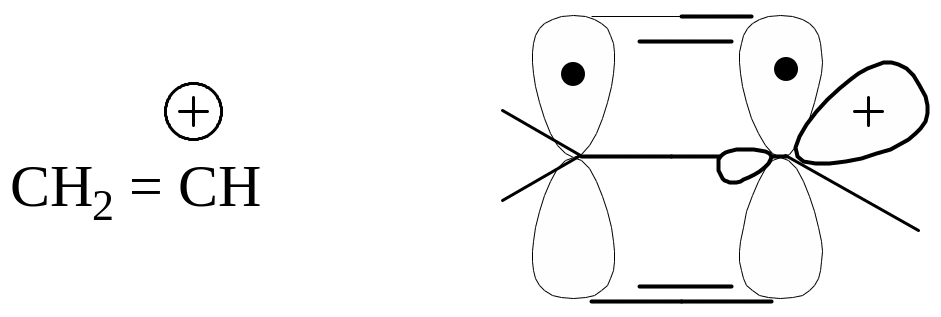
Аллилхлорид более реакционноспособен, чем винилхлорид.
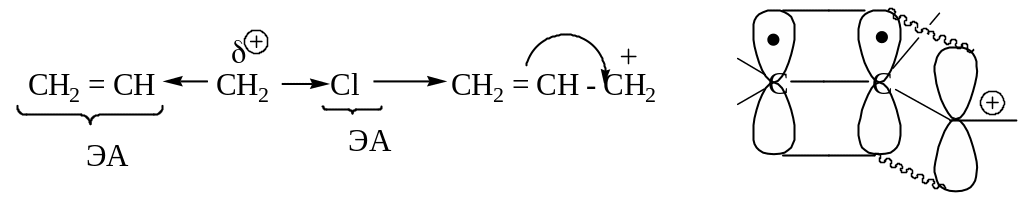
Реакции идут по SN1 механизму через образование стабильного карбкатиона с делокализованным зарядом вследствие сопряжения вакантной р-орбитали с р-орбиталью π-связи.
Сравнение реакционной способности фенил- и бензилгалогенидов.
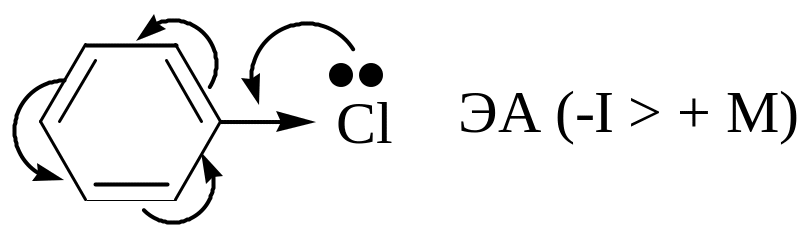
фенилхлорид (хлорбензол)
Причины низкой реакционной способности:
электронная дефицитность понижена (+МCl).
связь C – Cl более прочная (характер двоесвязанности).
SN2 механизм невозможен из-за пространственных и электронных препятствий со стороны бензольного кольца.
SN1 механизм невозможен из-за нестабильности гипотетического карбкатиона (делокализация положительного заряда невозможна, т.к. вакантная sp2-гибридная орбиталь находится в плоскости, перпендикулярной плоскости расположения р-орбиталей кольца).
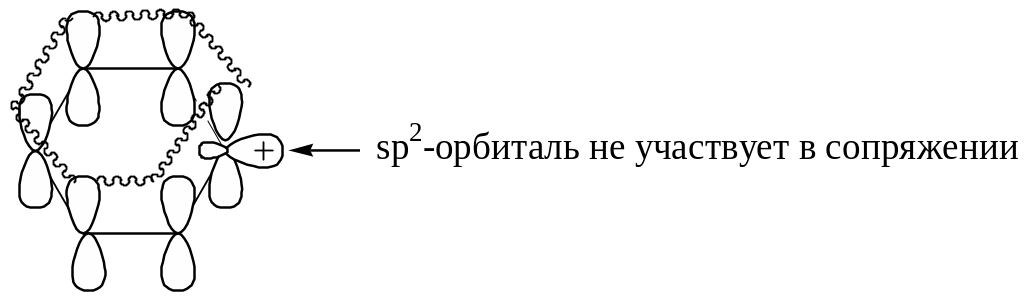
Фенилгалогениды могут вступать в реакции SN только:
в жестких условиях, или
при наличии сильных ЭА-заместителей в о- и n- положении,
в присутствии сильных оснований.
Бензилхлорид.
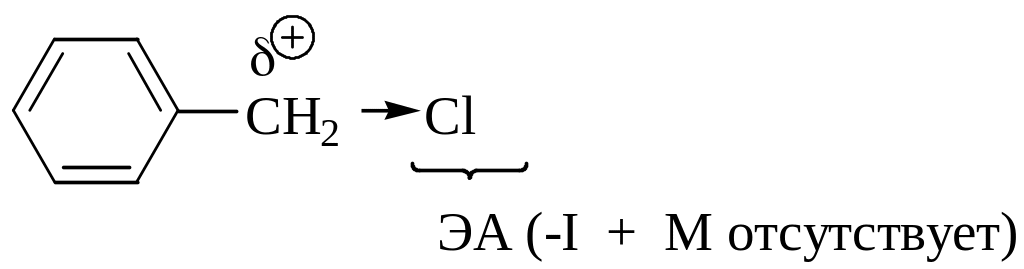
Реакционноспособен, в отличие от первичных галогеналканов, вступает в реакции SN1 с образованием карбкатиона, стабилизированного по резонансному механизму.

