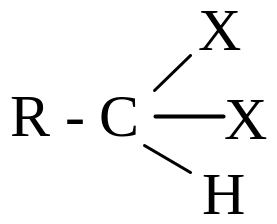- •Полифункциональные производные.
- •Тиоаналоги.
- •Реакционные центры, типы реакций.
- •Генетическая связь классов органических соединений.
- •Реакции нуклеофильного замещения.
- •Механизм реакции.
- •I Стадия (медленная) – образование карбкатиона.
- •II Стадия (быстрая) – стабилизация карбкатиона.
- •Сравнение реакционной способности в реакциях sn.
- •1. Сравнение реакционной способности хлор-, бром- йодпроизводных алканов.
- •2. Сравнение реакционной способности первичных, вторичных, третичных галогеналканов (спиртов).
- •Сравнение реакционной способности винил- и аллилгалогенидов.
- •Аллилхлорид более реакционноспособен, чем винилхлорид.
- •Сравнение реакционной способности фенил- и бензилгалогенидов.
- •Причины низкой реакционной способности:
- •Бензилхлорид.
- •Сравнение реакционной способности в реакциях sn галогеналканов, спиртов, простых эфиров.
- •Реакции элиминирования (е).
- •Стереохимическая направленность реакций элиминирования (е).
- •Реакции с участием нуклеофильного центра.
- •Факторы, влияющие на степень нуклеофильности.
- •Сравнительная оценка нуклеофильность тиолов, спиртов, фенолов (нуклеофильных реагентов).
- •Примеры реакций.
- •1. Реакция межмолекулярной дегидратации.
- •3. Конкурирующая реакции – дегидрогалогенирование.
- •Примеры.
- •3. Избирательное ацилирование соединений с одновременным содержанием спиртового и фенольного гидроксилов.
- •Реакции идентификации спиртов, фенолов, простых эфиров. Химизм реакций.
- •I. Кислотные свойства – образование солей.
- •II. Образование гликолятов меди – обнаружение вицинального диольного фрагмента.
- •3. Взаимодействие со щелочами (для нерастворимых в воде он-кислот).
Лекция 5.
ГАЛОГЕНО-, ГИДРОКСИ- И АЛКОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ. ТИОАНАЛОГИ.
Определение, классификация, функциональные группы.
Монофункциональные производные.
Таблица 1.
Галогенопроизводные углеводородов
(X: F, Cl, Br, I) |
Спирты
|
Фенолы
|
Простые эфиры
|
Функциональные группы |
|||
фтор, хлор, бром, йод |
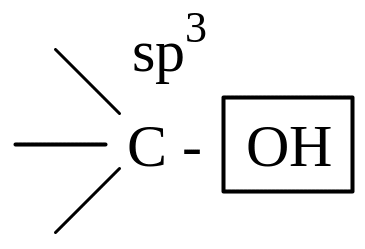
спиртовой гидроксил- (связан с sp3-атомом углерода) |
фенольный гидроксил (связан с бензольным кольцом) |
окси- |
1. Галогеналканы: - первичные
- вторичные
- третичные
2. Галогеналкены: - винилгалогениды R – CH = CH – X - аллилгалогениды R – CH = CH – CH2 – X 3. Бензилгалогениды:
4. Фенилгалогениды:
|
Спирты. - первичные
- вторичные
- третичные
- виниловые спирты* R – CH = CH – OH - аллиловые спирты R – CH = CH - CH2 - OH - бензиловые спирты
– |
- фенолы
|
1. Симметричные R – O – R
2. Несимметричные R – O – R’
3. Алифатические AlK – O – AlK
4. Ароматические Ar – O – Ar
5. Смешанные AlK – O - Ar |
Полифункциональные производные.
Таблица 2.
Галогенопроизводные |
Спирты |
Фенолы |
1. Вицинальные дигалогениды
|
1. Вицинальные диолы (гликоли)
2. Глицерины (3-ОН) 3. Тетриты (4-ОН) 4. Пентиты (5-ОН) 5. Гекситы (6-ОН) |
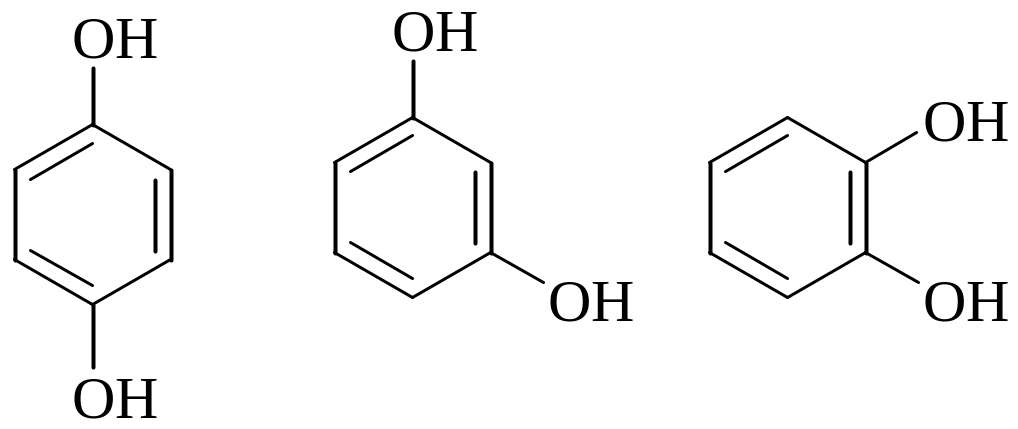
1. Двухатомные:
гидрохинон резорцин пирокатехин 2. Трехатомные:
флороглюцин |
2. Геминальные дигалогениды
|
|
- |
3. Галоформы: хлороформ CHCl3 бромоформ CHBr3 йодоформ CHI3 |
ортокислота |
- |
4. CCl4 |
ортоугольная кислота |
- |
Примечания:
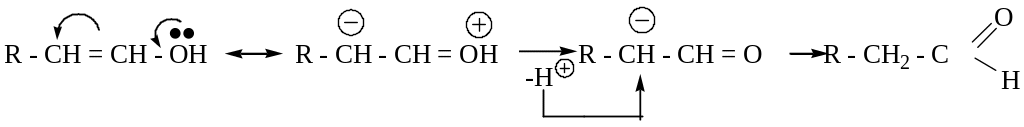
* - название «виниловые спирты» не соответствуют определению класса «спирты», т.к. ОН-группа связана не с sp3-, а sp2- гибридизованным атомом углерода. Их правильное название «енолы».
Енолы – неустойчивые соединения. Согласно правилу Эльтекова, изомеризуются в альдегиды или кетоны.
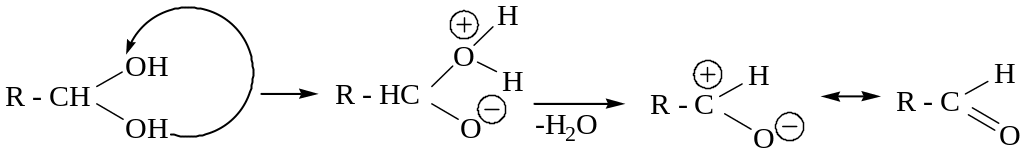
** - гем.-диолы, гем.-триолы (ортокислоты) и ортоугольная кислота в свободном состоянии неустойчивы. Согласно правилу Эрленмейера, легко дегидратируются с образованием альдегидов, кетонов или кислот.
Правило Эрленмейера – соединения, содержащие две и более сильных ЭА-групп, в свободном состоянии неустойчивы и легко дегидратируются при условии возможности внутримолекулярного протонирования с целью формирования хорошей уходящей группы.
Соединения общей формулы:
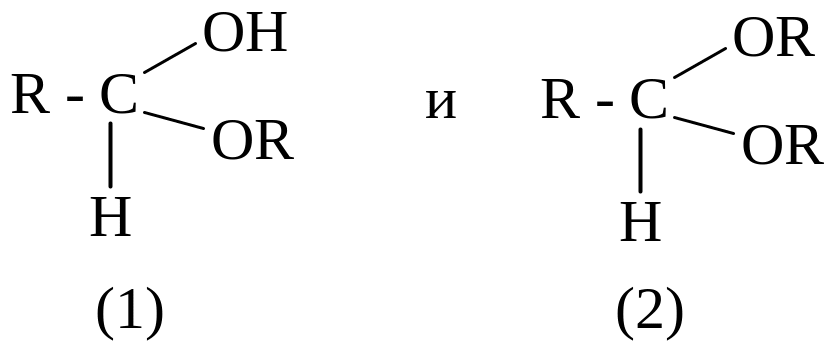 не
являются спиртами и простыми эфирами.
не
являются спиртами и простыми эфирами.
1 – полуацетали; 2 – ацетали
Тиоаналоги.
Таблица 3.
Название класса |
Общая формула |
Функциональная группа |
Название функциональной группы |
Тиолы
Тиофенолы
Сульфиды |
|
- SH
- SH
- S - |
Тиольная, сульфгидрильная
Тиольная
Тио |
Примечание: - SH – группа как заместитель имеет название «меркапто»;
- термин «меркаптан» употребляется только в радикало-функциональной номенклатуре как родовое название класса тиолов;
- термины «тиоспирты» и «тиоэфиры» в современной номенклату ре не употребляются.
Реакционные центры, типы реакций.
Таблица 4
Класс соединения |
Реакционный центр |
Атакующая частица |
Тип, механизм реакции |
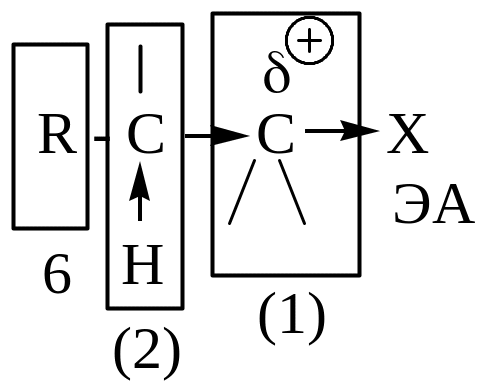
Галогеналканы.
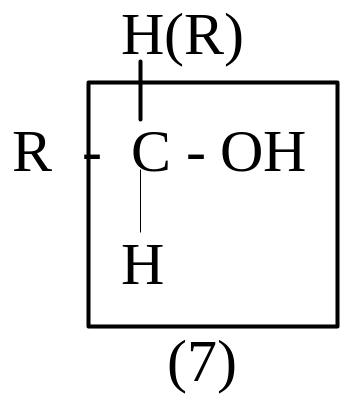
Спирты
Простые эфиры
(1)
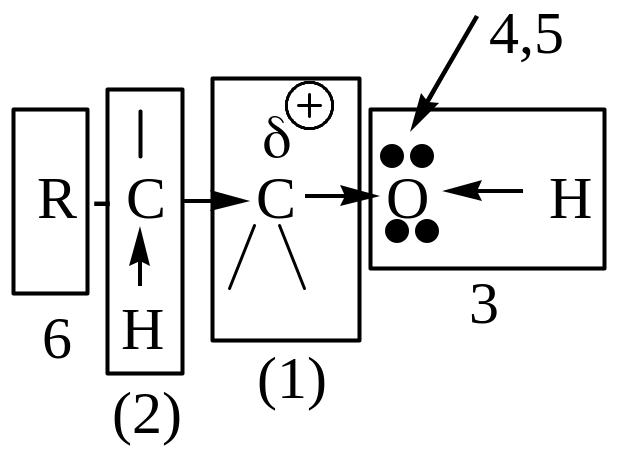
Тиолы
Спирты
|
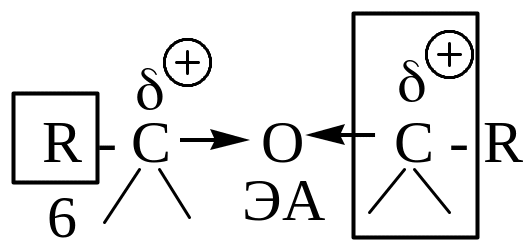
(1) – электрофильный (электронодефицитный) вследствие ЭА-влияния функциональной группы; у спиртов электрофильность меньше, т.к. атом кислорода, являясь двухковалентным, проявляет свое ЭА-влияние на два атома; у простых эфиров электрофильность еще меньше вследствие ЭД-влияния алкильных радикалов. (2) – β-СН-кислотный центр, возникает вследствие ЭА-влияния функциональной группы.
(3) – ОН- или SH- кислотные центры.
(4) – нуклеофильный реакционный центр
(5) – основный реакционный центр
(6) – алкил-, алкенил-, арил-
|
Nu
Нуклеофил-сильное основание
основания
Е
кислота
R` E E
[O] |
Дегидрогалогенирование (у галогеналканов), дегидратация (у спиртов)
образование солей
алкилирование ацилирование
образование солей
SR AE SE
окисление, образование альдегидов или кетонов |