
- •Лекция 2 пространственное строение органических молекул. Стереоизомерия.
- •Виды изомерии.
- •Способы установления хиральности молекулы.
- •2. Использование элементов симметрии.
- •3. Наличие хиральных центров.
- •Способы изображения конфигурации.
- •Стереохимические формулы в клиновидной записи.
- •2. Проекционные формулы Фишера l-молочной кислоты.
- •Способы преобразования проекционных формул.
- •Стереохимические ряды.
- •Диастереомерия.
- •Трео- и эритро- изомеры.
- •Свойства стереоизомеров.
- •Энантиомеры, рацематы, диастереомеры, мезо-формы (свойства).
- •Сравнение свойств винных кислот.
- •Необходимые условия проявления оптической активности.
- •Конформации ациклических соединений.
- •Потенциальная энергия конформации н-бутана.
- •Стабилизация аксиального конформера за счет водородной связи.
- •Конформационный анализ дизамещенных циклогексанов.
Свойства стереоизомеров.
Оптическая активность – способность вещества вращать плоскость поляризации.
Плоскость поляризации – плоскость, в которой происходят колебания поляризованного луча.
Оптически активные вещества – вещества, способные вращать плоскость поляризации.
Правовращающее вещество вращает плоскость поляризации вправо. Обозначается (+) или d (лат. dextrum – правый).
Левовращающее вещество вращает плоскость поляризации влево. Обозначается (-) или l (лат. laevus – левый).
Оптическая активность определяется с помощью поляриметра и выражается через величину удельного вращения:
![]()
- рабочий угол, измеренный на поляриметре,
l – толщина слоя жидкого вещества или раствора, в см
с – концентрация раствора, г/100 мл.
Схема устройства поляриметра.
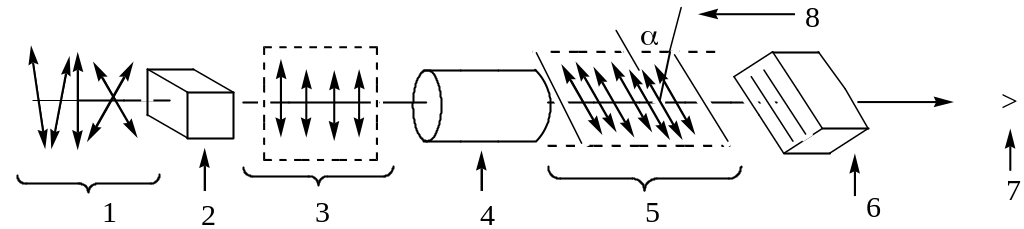
1 – Обычный свет
2 – Поляризатор
3 – Плоскость поляризации
4 – Поляриметрическая трубка
5 – Плоскость поляризованного луча, отклоненная на угол после прохождения света через оптически активное вещество
6 – Анализатор
7 – Глаз наблюдателя
8 – Угол вращения плоскости поляризации ().
Энантиомеры, рацематы, диастереомеры, мезо-формы (свойства).
Энантиомеры различаются физическими и химическими свойствами только в хиральных системах.
Их удельное вращение равно по величине и противоположно по направлению. Образуют рацемическую форму (рацемат).
Рацемат – эквимолярная смесь энантиомеров, не обладающая оптической активностью вследствие компенсации вращения. Обозначается () или d, l или D, L-. Рацемат можно разделить на энантиомеры.
Диастереомеры различаются по свойствам значительно. Удельное вращение их может иметь одинаковый или противоположный знак и разную величину. Рацематов не образуют.
Мезо-формы не обладают оптической активностью вследствие внутренней компенсации вращения обеими зеркально противоположными половинами.
Таблица 1
Сравнение свойств винных кислот.
Винная кислота |
[]20D |
Т. пл., оС |
L D мезо D, L (виноградная) |
- 11.98 + 11.98 0,00 0,00 |
168 – 170 168 – 170 140 206 |
Необходимые условия проявления оптической активности.
Хиральность молекулы.
Конфигурационная устойчивость.
Третичные амины конфигурационно неустойчивые, т.к. четвертым партнером хирального атома азота является свободная орбиталь, вследствие чего возможен равновероятный обратимый переход одного энантиомера в другой с образованием рацемической смеси.
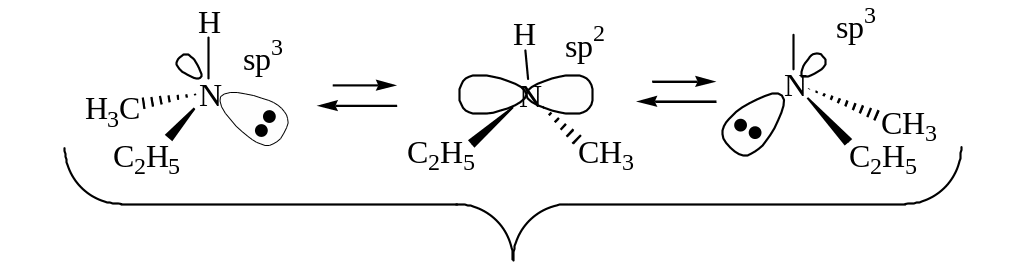
Рацемат
Рацематы, образованные из конфигурационно неустойчивых энантиомеров, разделить на энантиомеры невозможно. Соли четвертичных аммониевых оснований с 4-мя различными радикалами конфигурационно устойчивые, обладают оптической активностью. Их рацематы разделимы на энантиомеры.
Стереоизомерия замещенных циклоалканов.
Оптическая изомерия, обусловленная наличием хиральных центров.
Геометрическая цис-транс-изомерия, обусловленная различным расположением заместителей относительно плоскости кольца.
Циклопропандикарбоновые кислоты.
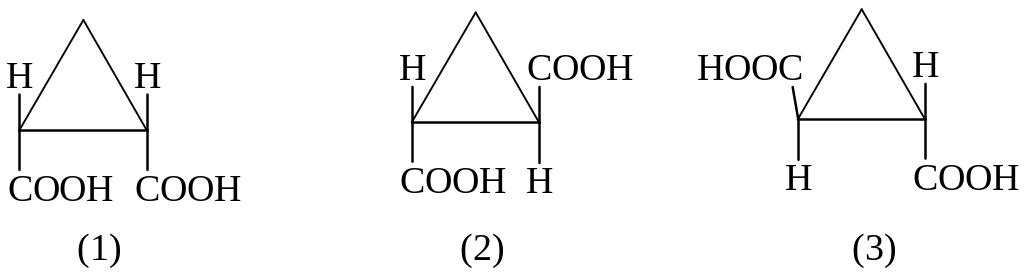
цис-изомер транс-изомер транс-изомер
1,2 и 1,3 – пары диастереомеров
2,3 – пара энантиомеров.
Цис-изомер – мезоформа, не обладает оптической активностью.
Конформационная изомерия.
Виды напряжений в органических молекулах.
1. Торсионное напряжение (напряжение Питцера) вызвано электростатическим взаимодействием провостоящих связей.
2. Напряжение Ван-дер-Ваальса, возникающее при расположении заместителей на расстояние, приблизительно равное сумме их ван-дер-ваальсовых радиусов.
3. Угловое напряжение (напряжение Байера), вызванное отклонением валентного угла в цикле от нормального угла для данного валентного состояния.
Геометрия реальной молекулы соответствует той конформации, в которой энергия внутримолекулярных взаимодействий имеет минимальное значение.
