
- •Экзаменационные ответы (физколлоидная химия)
- •Формулировки первого закона термодинамики:
- •Уравнение для бесконечно малых элементарных процессов:
- •Значение первого начала (закона) термодинамики
- •Закон Гесса:
- •Следствия из закона Гесса:
- •Зависимость теплового эффекта химической реакции от температуры:
- •Закон (уравнения) Кирхгофа и его решение:
- •Решение интегральной формы уравнения Кирхгофа. Рассматривают 2 приближения:
- •1 Приближение
- •2 Приближение
- •О бозначение стандартных теплот образования
- •О бозначение стандартных теплот сгорания
- •Классификация термодинамических параметров состояния системы:
- •Сходные свойства внутренней энергии и энтальпии
- •Доказательство внутренней энергии – функции состояния
- •Сущность теплоты
- •Сущность работы. 3 ситуационных случая:
- •Сходные свойства теплоты и работы
- •Различие теплоты и работы
- •Отличие термодинамической обратимости от химической
- •Энтропийная формулировка второго начала (закона возрастания энтропии) термодинамики
- •Следствие закона возрастания энтропии
- •Вычисление энтропии при различных процессах
- •1 Приближение
- •2 Приближение
- •Третий закон (начало) термодинамики:
- •Объединённое первое и второе начало термодинамики
- •Энтропийный принцип для специальных процессов
- •Сходные свойства энергии Гельмгольца и Гиббса
- •Критерии энергии Гельмгольца, характеризующие направленность самопроизвольных процессов
- •Критерии энергии Гиббса, характеризующие направленность самопроизвольных процессов
- •Критерии энергии Гиббса при протекании химической реакции:
- •Химимческий потенциал индивидуального газа в индивидуальном состоянии
- •Химимческий потенциал реального газа в индивидуальном состоянии
- •Химический потенциал реального раствора
- •Влияние концентрации
- •Константа равновесия для растворов
- •Анализ изобары Вант-Гоффа. Зависимость константы химического равновесия от температуры
- •Уравнение изобары и изохоры Вант-Гоффа и их решения. Следствия, вытекающие из этих уравнений. Принцип Ле-Шателье.
- •Уравнение изобары и изохоры Вант – Гоффа и их решения
- •Принцип Ле-Шателье
- •Вычисление константы химического равновесия по стандартным термодинамическим величинам.
- •1 Приближение
- •2 Приближение
- •В основе анализа диаграмм состояния лежат два общих положения:
- •Правило фаз Гиббса (формулировка и математическое выражение)
- •Применение диаграмм состояния и правила фаз Гиббса к однокомпонентным системам
- •3 Возможных случая:
- •Диаграмма состояния серы
- •4 Фазы (агрегатных состояния) у серы:
- •1 ) Твёрдое состояние (две модификации):
- •Разделение фаз шестью линиями – фазовыми равновесиями:
- •3 Возможных случая:
- •Фазовое равновесие в однокомпонентной системе на примере диаграммы состояния воды и серы. Диаграммы состояния воды
- •3 Возможных случая:
- •Определение наклона кривых по уравнению Клапейрона
- •Диаграмма состояния серы
- •4 Фазы (агрегатных состояния) у серы:
- •1 ) Твёрдое состояние (две модификации):
- •Разделение фаз шестью линиями – фазовыми равновесиями: Уравнение Клапейрона – Клаузиуса и его решение
- •Условная классификация твёрдых веществ по растворимости:
- •Зависимость растворимости веществ от температуры и давления: Растворимость твёрдых веществ:
- •Растворимость жидких веществ:
- •Растворимость газообразных веществ:
- •Уравнение состояния идеальных газов для разбавленных растворов.
- •Законы Рауля Первая форма
- •Первая форма закона Рауля, применимое к растворителю и растворённому веществу:
- •Закон Рауля, применимый к растворителю:
- •Вторая форма закона Рауля – понижение давления насыщенного пара растворителя над раствором:
- •Вывод по обеим формам закона Рауля:
- •1. Понижение давления насыщенного пара растворителя над раствором – вторая форма закона Рауля
- •2. Повышение температуры кипения растворов – разность температур кипения растворов и растворителей
- •Понижение температуры замерзания растворов – разность температур замерзания растворителей и растворов
- •Уравнение состояния идеальных газов для разбавленных растворов.
- •Физико-химический метод анализа
- •Принцип построения диаграммы состояния
- •Кривые охлаждения и диаграмма состояния
- •Диаграмма плавкости двухкомпонентных систем, нерастворимых в твёрдом состоянии
- •Поля диаграммы, образованные линиями ликвидуса и солидуса
- •Определение состояния системы при изменении её параметров
- •Система, заданная точкой а Система, заданная точкой b
- •Диграммы плавкости двухкомпонентных систем с неограниченной растворимостью в жидком и твердом состоянии
- •Процесс охлаждения расплава
- •Если система задана фигуративной точкой а, то:
- •Значение фазовых диаграмм для фармации
- •Равновесие жидкость-пар в двухкомпонентных растворах. Первый и второй законы Коновалова. Основы дробной и непрерывной перегонок.
- •При давлении р2
- •Первый закон Коновалова:
- •Обоснование математических неравенств составов равновесных фаз
- •Основы непрерывной (простой) перегонки
- •Основы дробной (фракционной) перегонки
- •Ректификация
- •Влияние температуры на растворимость
- •По характеру зависимости взаимной растворимости от температуры ограниченно растворимые жидкости делят на 4 типа:
- •Ограниченно растворимые жидкости с верхней критической температурой растворения (фенол – вода, анилин – вода).
- •Процессы охлаждения
- •Ограниченно растворимые жидкости с нижней критической температурой растворения (триэтиламин — вода, диэтиламин — вода)
- •Ограниченно растворимые жидкости с верхней и нижней критическими температурами растворения (никотин — вода, глицерин — гваякол)
- •Взаимно нерастворимые жидкости Диаграмма состояния взаимно нерастворимых жидкостей. Зависимость давления пара этих жидкостей от температуры
- •Расчёт давления пара каждой жидкости над смесью в идеальной системе по закону Рауля
- •Расчёт общего давления по закону Дальтона
- •Перегонка с водяным паром
- •Связь давления и количества каждой жидкости в конденсате
- •Можно рассчитать массу каждой жидкости в конденсате по формулам, полученным в результате применения уравнения Менделеева – Клапейрона
- •Отношение полученных последних выражений
- •Закон распределения веществ между двумя несмешивающимися жидкостями. Коэффициент распределения. Принцип получения настоек и отваров. Экстракция.
- •Закон распределения
- •Коэффициент распределения равен отношению равновесной концентрации распределяемого вещества в органической фазе к его концентрации в водной фазе:
- •Установление сложного равновесия между простыми и ассоциированными молекулами или ионами в пределах каждой фазы при диссоциации и ассоциации распределяемого вещества
- •Принцип получения настоек и отваров
- •1. Понижение давления насыщенного пара растворителя над раствором – вторая форма закона Рауля
- •2. Повышение температуры кипения растворов – разность температур кипения растворов и растворителей
- •3. Понижение температуры замерзания растворов – разность температур замерзания растворителей и растворов
- •Уравнение состояния идеальных газов для разбавленных растворов.
- •Расчёт термодинамической константы диссоциации
- •Расчёт активности
- •Расчёт коэффициента активности в разбавленном растворе
- •Особенности свойств сильных электролитов
- •Теория Дебая и Хюккеля
- •Расчет коэффициента активности Вычисление коэффициента активности через толщину ионной атмосферы
- •3 Приближения теории Дебая – Хюккеля для расчёта коэффициента активности: Первое приближение – предельный закон Дебая
- •Второе приближение
- •Коэффициент в рассчитывают по уравнению
- •Третее приближение
- •Вычисление среднего ионного моляльного коэффициента активности для 1,1-валентного электролита
- •Вычисление среднего ионного моляльного коэффициента
- •Зависимость логарифма среднеионного коэффициента активности от корня квадратного из ионной силы раствора
- •Упрощающие допущения заключаются в том, что:
- •Расчёт активности
- •Расчет коэффициента активности Вычисление коэффициента активности через толщину ионной атмосферы
- •3 Приближения теории Дебая – Хюккеля для расчёта коэффициента активности: Предельный закон Дебая – первое приближение
- •Второе приближение
- •Коэффициент в рассчитывают по уравнению
- •Третее приближение
- •Вычисление среднего ионного моляльного коэффициента активности для 1,1-валентного электролита Вычисление среднего ионного моляльного коэффициента
- •Правило ионной силы Льюиса
- •Виды электропроводимости:
- •Величина тока, создаваемая катионами и анионами
- •Суммарный ток равен сумме токов, создаваемых катионами и анионами
- •Зависимость удельной электропроводимости растворов электролитов от концентрации
- •Расчёт электропроводимости для слабых электролитов, определяемой степенью диссоциации
- •Электрическую проводимость растворов см. Вопрос № 31 !!! Кондуктометрия как метод анализа
- •Виды кондуктометрического метода анализа:
- •Классификация буферных систем:
- •Механизм действия буферных растворов на примерах ацетатного, фосфатного и гидрокарбонатно-гемоглобинового буферов
- •Уравнение Гендерсона –Гассельбаха
- •Гидрокарбонатно-гемоглобиновая система
- •Диссоциация компонентов
- •Факторы, влияющие на буферную ёмкость:
- •Значение буферных систем для химии и биологии
- •Классификация электродов:
- •Классификация обратимых электродов:
- •По свойствам веществ, участвующих в потенциалопределяющих процессах и по устройству:
- •По принципу применения:
- •Три механизма возникновения электрического заряда на поверхности раздела фаз:
- •Устройство гальванического элемента:
- •Теории возникновения скачка потенциала на границе металл — раствор Три положения осмотической теории в. Нернста:
- •Три случая, характеризующие природу металла и состав раствора:
- •Гальвани-потенциал отождествляется с электродным потенциалом
- •Сольватационная теория (л. В. Писаржевского) электродного потенциала — главные процессы, протекающие при возникновении электродного потенциала:
- •Развитие сольватационной теории возникновения электродного потенциала н. А. Изгарышевым
- •Результаты исследования и выводы у. Герни по развитию сольватационной теории возникновения электродного потенциала
- •Объединённые результаты исследований в. Нернста, н. А. Изгарышева и у. Герни — сольватационная теория возникновения электродного потенциала
- •Вычисление работы (энергии) выхода иона из металла ( Uм ) и энергии его сольватации ( Uсол )
- •3 Ситуационных случая:
- •Выражение химического потенциала иона в растворе
- •Уравнение Нернста для электродного потенциала с
- •Устройство водородного электрода
- •Механизм возникновения потенциала на водородном электроде
- •Анионов хлорида серебра в насыщенном растворе
- •Выражение для потенциала каломельного электрода и его физический смысл
- •Электродная схема и уравнение потенциалопределяющего процесса
- •Две разновидности окислительно-восстановительных электродов:
- •Электроды, потенциал которых не зависит от активности ионов водорода
- •Электроды, потенциал которых зависит от активности ионов водорода
- •Применение стеклянного электрода
- •Количественная характеристика величины скачка потенциала на границе фаз стекло – раствор:
- •Окончательное выражение для потенциала стеклянного электрода
- •Кривые потенциометрического титрования.
- •Определение объема титранта расчётным путем
- •Кислотно-основное титрование
- •Зависимость скорости и константы скорости реакций от различных факторов
- •Различают:
- •Вопрос № 39
- •Реакции второго порядка
- •Различают:
- •Методы определения порядков реакции:
- •Интегральные методы
- •3) По периоду полураспада
- •Дифференциальные методы Вант-Гоффа Зависимость скорости химической реакции n – ного порядка от концентрации
- •Метод заключается в:
- •Применение дифференциального метода в двух вариантах:
- •Зависимость скорости химической реакции от температуры
- •Уравнение Аррениуса в интегральной форме
- •Теория переходного состояния или активированного комплекса
- •Две задачи в теории абсолютных скоростей:
- •Уравнение поверхности потенциальной энергии
- •Уравнение константы скорости реакций
- •Деление реакций на 3 группы по значению δs≠ :
Экзаменационные ответы (физколлоидная химия)
ВОПРОС № 1
Первое начало (закон) термодинамики – это закон сохранения энергии для тепловых процессов.
Формулировки первого закона термодинамики:
дщЭнергия изолированной системы постоянна.
Если бы энергия изолированной системы увеличивалась без взаимодействия системы с окружающей средой, то существовал бы вечный двигатель первого рода – машина, производящая полезную работу без потребления и затраты энергии. Однако:Вечный двигатель первого рода невозможен.
Постоянство энергии изолированной системы осуществляет переход одного вида энергии в другой, в результате которого энергия не теряется и не создается вновь. Любая машина может совершать работу над внешними телами только при получении извне некоторого количества теплоты или уменьшения её внутренней энергии. Отсюда третья формулировка первого закона, вытекающая из закона сохранения энергии: Энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в другой происходит в строго эквивалентных количествах. Из закона сохранения энергии следуют математические выражения первого закона термодинамики: Q = ΔU + W,
Q — количество сообщенной системе теплоты, абсолютное значение количества теплоты ( Дж );
ΔU — приращение внутренней энергии ( Дж );
W — суммарная работа, совершаемая системой, абсолютное значение работы ( Дж ).
Теплота и работа — функции процесса, поэтому они не могут быть выражены в форме ΔQ и ΔW.
Уравнение для бесконечно малых элементарных процессов:
![]() δQ
= dU
+ δW
= dU
+ pdV
δW*,
δQ
= dU
+ δW
= dU
+ pdV
δW*,
δW = pdV — работа расширения — элементарная работа, совершаемая термодинамической системой против внешних сил,
δW* = 0 — работа сжатия (полезная работа) — работа внешних сил, совершаемая над термодинамической системой. Работа внешних сил — мера энергии, переданной телу при механическом взаимодействии его с другими телами. Сумма всех остальных видов элементарных работ (магнитная, электрическая и др.).
Отсюда следует ещё одно выражение:

δQ = d U + pdV .
В неизолированной термодинамической системе количество теплоты, подведенное к системе или отведенное от нее, идет на изменение внутренней энергии и на работу, совершаемую системой или над системой.
Смысл первого закона термодинамики — внутренняя энергия тела, взаимодействующего с другими телами, меняется за счет двух процессов — теплообмена и работы внешних сил. Любое увеличение внутренней энергии тела сопровождается уменьшением энергии взаимодействующих с ним тел. Количество теплоты — мера энергии, переданной от других тел путем теплопередачи в результате ударов молекул о границу их раздела.
Математические выражения первого начала (закона) термодинамики для различных процессов: изотермического, изохорного и изобарного.
![]() —
процесс
расширения
—
процесс
расширения
![]() —
процесс
сжатия
—
процесс
сжатия
![]()
Изотермический процесс – передача теплоты от одного тела к другому при постоянной температуре. Внутренняя энергия 1 моль идеального газа зависит только от температуры. |
Изохорный процесс – процесс, протекающий при постоянном объёме. |
Изобарный процесс – процесс, протекающий при постоянном давлении. |
Если T = const или dT = const (T = 0 или dT = 0), то ΔU = const или dU = const (ΔU = 0 или dU = 0) Следовательно
При изотермическом сжатии идеального газа переданное количество теплоты равно работе, совершаемой внешними силами над системой с противоположным знаком (работе сжатия с противоположным знаком). При изотермическом процессе сообщённая системе теплота целиком превращается в работу расширения. При изотермическом расширении идеального газа переданное количество теплоты равно работе, совершаемой системой против внешних сил (работе расширения). QT — изотермическая теплота — функция процесса. Если из уравнения Менделеева-Клапейрона выразить объём и давление, затем подставить эти выражения в следующие уравнения и проинтегрировать, то получим выражения для идеального газа при изотермическом процессе:
|
Работа расширения и работа сжатия идеального газа равны нулю, изменение внутренней энергии равно полученному количеству теплоты. QV — изохорическая теплота приобретает свойство функции состояния. |
Qp — изобарическая теплота приобретает свойство функции состояния. Изобарное расширение идеального газа – повышение температуры при нагревании идеального газа, совершение работы термодинамической системы, увеличение внутренней энергии. Изобарное сжатие идеального газа – понижение температуры при охлаждении идеального газа, совершение работы внешних сил над термодинамической системой, уменьшение внутренней энергии. |


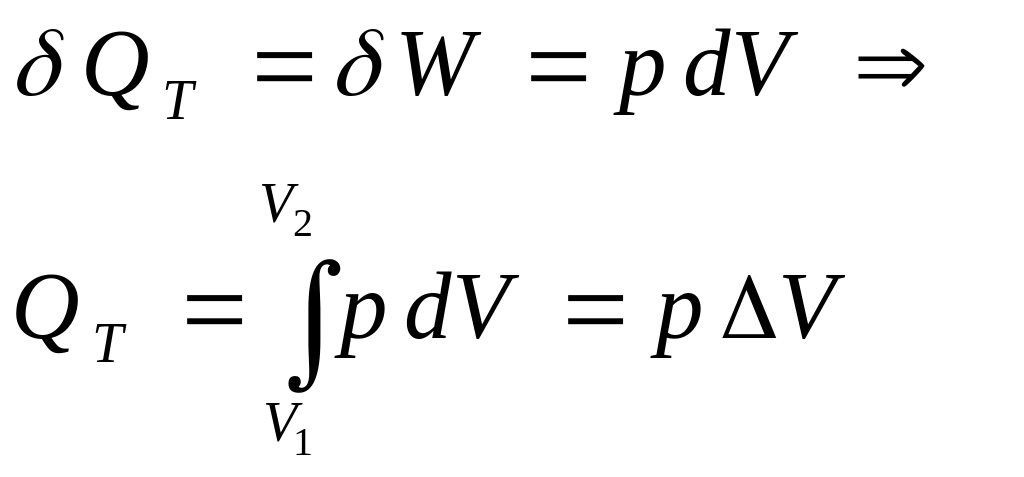


 Если
V = 0 или V
= const (dV
= 0 или dV = const),
то
Если
V = 0 или V
= const (dV
= 0 или dV = const),
то

 Если
р = const или р =
0 (dp = const
или dp = 0), то
Если
р = const или р =
0 (dp = const
или dp = 0), то