
- •20. Структура и элементарный состав топлив для двигателей.
- •23. Сгорание в дизельных двс
- •24. Нарушение процесса сгорания в дизельных двс
- •25. Внешнее смесеобразование в бензиновых двс
- •26. Смесеобразование бензиновых двс с непосредственным впрыском
- •27. Период задержки воспламенения, влияние на рабочий процесс и факторы от которых он зависит
- •28. Процесс расширения, назначение и параметры процесса.
- •29. Процесс выпуска, коэффициент остаточных газов
20. Структура и элементарный состав топлив для двигателей.
Структура топлива. В двигателях внутреннего сгорания применяют жидкие и газообразные топлива. Главным источником для получения жидкого топлива является природная нефть. В результате ее прямой перегонки и специальной вторичной переработки получают бензин, лигроин, керосин, дизельное топливо, соляровое масло, мазут и т. п. Кроме того, жидкое топливо можно получать также путем специальной переработки каменного и бурого угля, а также сланцев. В автомобильных и тракторных двигателях применяют бенгин, дизельное топливо, а также газовое топливо. В распространенных в настоящее время многотопливных дизелях состав применяемых топлив расширился. В них может быть использовано до 71 % топливных фракций нефти (в карбюраторных двигателях и дизелях, взятых вместе только 54%).
Жидкое топливо состоит в основном из смеси углеводородов, которые отличаются по групповому составу, определяющему химическую структуру топлива, и элементарному составу, показывающему содержание в нем отдельных элементов. Групповой состав характеризует содержание в топливе углеводородов различных гомологических рядов. Он определяет основные физико-химические свойства тоилива и влияет на процессы испарения, воспламенения и горения топлива.
Основными составляющими нефти являются углеводороды: парафины (ал-каны) вида СиН2п+2, нафтены (цикланы) вида СИН2П и ароматические углеводороды вида СпН2я_в и СпН2п_г2. Олефиновые, диолефиновые и ацетиленовые углеводороды содержатся в нефти в незначительных количествах. В среднем в нефти содержится 8485% углерода и 1214% водорода, остальное составляют азот, кислород и сера. Углеводороды, входящие в состав жидких топлив, имеют в одной молекуле 530 атомов углерода (в бензине 512, в керосине и дизельном топливе до 30).
Насыщенные углеводороды принадлежат к цепным органическим соединениям. Они могут иметь прямые или разветвленные цепочки углеродных атомов (алканы и изоалканы) и цепочки, замкнутые в кольца (цикланы). У этих углеводородов цепи атомов углерода соединены одинарными связями и полностью насыщены атомами водорода. У нормальных алканов (Н-алканы) цепи атомов углерода неразветвленные. В нефти наряду с Н-алканами находятся изомерные им углеводороды, имеющие структуру, при которой атомы углерода в молекулах образуют разветвленные цепи.
В качестве примера Н-алкана и его изомера И-алкана ниже приведены структурные формулы бутана, изобутана, октана и изооктана:
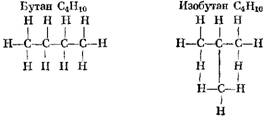
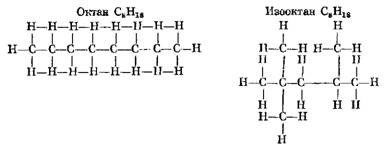
Чем более компактна молекула углеводорода, тем выше его детонационная стойкость, определяемая октановым числом.
В бензинах, применяемых в двигателях с искровым зажиганием, целесообразно в качестве компонентов иметь И-алканы, так как они обладают меньшей склонностью к детонации. Изооктан используют при сравнительной оценке детонационных качеств топлива. В дизельном топливе более ценными компонентами являются Н-алканы, обладающие по сравнению с изосоединениями более низкой температурой самовоспламенения, которая, кроме того, снижается с укрупнением молекулы. Поэтому в качестве дизельного топлива используют более тяжелые фракции нефти.
У цикланов, называемых также циклопарафинами, замкнутые кольца состоят из пяти или шести атомов углерода, соединенных между собой одинарными валентным связями.
В качестве примера ниже приведена структура молекулы циклопентанаСбН^!
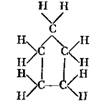
Такая структура молекул обеспечивает большую стойкость топлива к воспламенению. При содержании цикланов в бензине повышается его детонационная стойкость.
Ароматические углеводороды имеют кольцевое строение молекул с бензольным ядром из шести атомов углерода, связанных между собой тремя двойными и тремя одинарными связями.
Структурные формулы бензола и его первого гомолога метилбеизола (толуола) приведены ниже:

Высокая устойчивость ароматических углеводородов с бензольным ядром объясняется их кольцевой структурой. Содержание ароматических углеводородов в бензине повышает его детонационную стойкость. Количество ароматических углеводородов в бензине, получаемом прямой перегонкой нефти, составляет 1015%. Одним из способов повышения детонационной стойкости является применение каталитического реформинга. При этом способе можно образовать до 6570% ароматических соединений. Заметим, что бензины, содержащие ароматические соединения, обладают повышенной склонностью к нагарообразованию.
Элементарный состав топлива. Элементарным составом топлива называют массовое или объемное содержание отдельных элементов в топливе. Элементарный состав жидкого топлива принято выражать в единицах массы. Например, в 1 кг изооктана (C8Hi8) содержится 0,842 кг углерода (С) и 0,158 кг водорода (Н). Для 1 кг жидкого топлива, состоящего из углерода (С), водорода (Н) и кислорода (От), при отсутствии серы можно написать:
![]()
Газообразное топливо, применяемое для автомобильных двигателей, состоит из смеси различных газов горючих и инертных. Его состав принято выражать в объемных единицах или молях.
Для 1 м8 или 1 моля газообразного топлива, обозначая объемные доли каждого газа, входящего в смесь, химической формулой, можно
написать:
![]()
![]()
![]() ).
).
К газам, обладающим высокой теплотой сгорания относятся природные, нефтяные (промысловые), канализационные газы, а также метановая фракция коксового газа, получаемая на азотно-туковых заводах, к газам, имеющим средние значения, коксовый, городской (светильный) и некоторые промышленные газы.
![]() ,
При использовании на автомобилях
сжиженных газов снижаются требования
к устанавливаемым на автомобиле газовым
баллонам.
,
При использовании на автомобилях
сжиженных газов снижаются требования
к устанавливаемым на автомобиле газовым
баллонам.
Применяемые для автомобильных двигателей газообразные топлива транспортируются в баллонах в сжатом или в сжиженном состоянии. При использовании сжимаемого газа в автомобильных двигателях он подается из баллона через подогреватель и редуктор, в котором давление газа снижается до 0,1 МПа (атмосферное давление). В случае применения сжиженных газов они из баллона подаются в двигатель через теплообменник-испаритель и редуктор. В испарителе сжиженное топливо переходит в газообразное состояние, и в цилиндр двигателя через смеситель поступает гомогенная топливовоздушная смесь.
Наибольшее распространение в качестве топлива на автомобильных двигателях получили сжиженные газы.
21. Химические реакции при полном сгорании жидких топлив.
Сгорание топлива в цилиндре двигателя является сложным химическим процессом. Опуская все промежуточные стадии процесса сгорания, рассмотрим конечные химические реакции элементов, входящих в состав топлив, с кислородом воздуха. Химические реакции при полном сгорании жидкого топлива. При полном сгорании топлива предполагается, что в результате реакций углерода и водорода с кислородом воздуха образуются соответственно углекислый газ и водяной пар. В этом случае окисление углерода и водорода топлива соответствует химическим уравнениям:
![]()
22. Теоретически необходимое количество воздуха. Коэффициент избытка воздуха.
Теоретически необходимое количество воздуха для сгорания 1 кг топлива, кмоль/кг, определяют в зависимости от его элементарного химического состава: Lo = (C/12+H/4+S/32-O/32)/0.21
Для сгорания 1 кг дизельного топлива среднего элементарного химического состава, применяемого обычно в расчетах, теоретически необходимое количество воздуха Lo=0,495 кмоль/кг.
Теоретически необходимая масса воздуха для сгорания 1 кг упомянутого топливаGo =(мю)sLo= 28,95*0,495= 14,3 кг/кг (где относительная молярная масса воздуха (мю)s = 28,95 кг/моль).
Вследствие ограниченности периода, приходящегося на смесеобразование в дизеле, и недостаточно полного перемешивания топлива с воздухом топливовоздушная смесь в камере сгорания оказывается неравномерной. При подаче в цилиндр только теоретически необходимого количества воздуха сгорание топлива было бы неполным. Поэтому в реальных двигателях воздух для сгорания топлива подается с некоторым избытком. В расчетах это учитывают с помощью коэффициента избытка воздуха — отношения действительного количества воздуха, находящегося в цилиндре перед началом сгорания топлива, к теоретически необходимому: (альфа) = L/Lo
Отсюда действительное количество воздуха, расходуемое на сгорание 1 кг топлива, кмоль/кг, L=(альфа)*Lo
Коэффициент избытка воздуха (альфа)= 1/(1-3.76O2/N2), где О2 и N2 — объемные доли кислорода и азота в пробе газа.
