
- •Применение
- •Химические св-ва серы
- •Оксиды:
- •Сероводород.
- •Химические свойства
- •Серная кислота применение
- •Оксид азота (I) n2o
- •Оксид азота (II) no
- •Оксид азота (III) n2o3
- •Оксид азота (IV) no2
- •Нитрат аммония
- •Реакции разложения
- •Нитрит аммония
- •Окислительные св-ва азотной к-ты и зависимость продуктов её восстановления от концентрации и природы её восстановителя
- •Германий, олово, свинец. Оксиды и гидроксиды, их взаимодействие с кислотами и щелочами.
- •Германий
- •Характеристика.
- •Оксиды углерода:
- •Взаимодействие с неметаллами.
- •Применение.
- •Получение.
- •Подгруппа меди.
- •Сравнительная характеристика элементов главной и побочной подгруппы первой группы.
- •Нахождение в природе и способы получения.
Оксид азота (I) n2o
Получение: NH4NO3 → N2O↑ + 2H2O; Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой (NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2О). Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть.
При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.
При нагревании N2O разлагается: 2N2O → 2N2↑ + O2↑.
Степень окисления:+1.
Оксид азота (II) no
В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет. Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2.
Степень о-я: +2
Получение: единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде
![]()
Химические св-ва: 1)Легко окисляется кислородом воздуха до NO2
![]()
2) В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
![]()
Восстанавливается водородом до свободного азота.
Оксид азота (III) n2o3
Жидкость
синего цвета (при низких температурах),
бесцветный газ (при стандартных условиях),
в твёрдом виде — синеватого цвета.
Устойчив только при температурах ниже
−4 °C. При +3,5 ˚С
кипит,
разлагаясь на NO2
и NO:
![]()
Соответствует азотистая к-та HNO2, которую получают действием на её соли разбавленной серной к-той: 2NaNO2+ H2SO4= 2HNO2+ Na2SO4
Степень о-я:+3.
Оксид азота (IV) no2
Газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость. Тяжелее воздуха, раздражает дыхательные пути, ядовит. Оксид азота (IV)- сильный окислитель, многие вещества (уголь, сера, фосфор) горят в нём; оксид серы (IV) окисляется в нём до оксида серы (VI).
П олучение:
Разложение концентрированной азотной
к-ты
олучение:
Разложение концентрированной азотной
к-ты
4HNO3= 4NO2 +O2 +2H2O
Химические
св-ва:
1) Поскольку азотистая кислота
неустойчива, при растворении NO2
в тёплой воде образуются HNO3 и NO:
![]()
2) При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
![]()
3) При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
![]()
Нитрат аммония
Химическое соединение NH4NO3, соль азотной кислоты.
Реакции разложения
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Температура ниже 270 °C:
 .
.
Температура выше 270 °C, или детонация:
 .
.
Нитрит аммония
NH4NO2 — соль, белый, мелкокристаллический порошок, при хранении желтеет.
Аммония нитрит неустойчивое вещество и при нагревании разлагается:
![]()
при резком нагревании возможен взрывной характер разложения.
Как соль слабого основания и слабой кислоты разлагается кислотами и щелочами:
![]()
![]()
Окислительные св-ва азотной к-ты и зависимость продуктов её восстановления от концентрации и природы её восстановителя
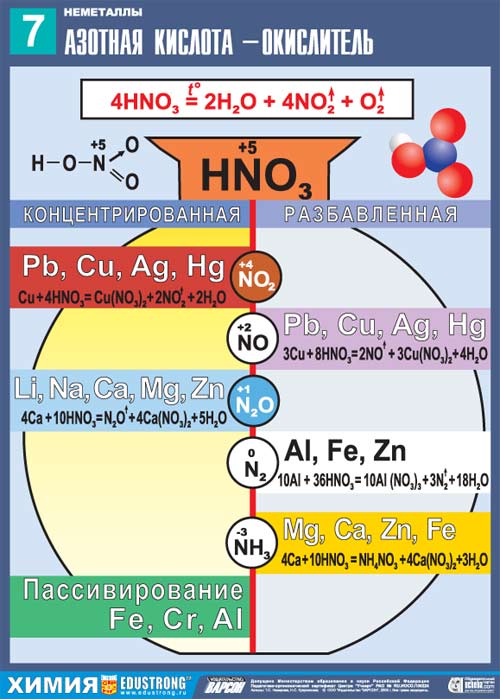
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
![]()
![]()
б) с металлами, стоящими в ряду напряжений левее водорода:
![]()
![]()
![]()
![]()
![]()
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение
концентрации кислоты
![]() увеличение
активности металла
увеличение
активности металла
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
![]()
![]()
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
![]()
![]()
![]()
![]()
и сложные вещества, например:
![]()
Вопрос №36
