
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Зависимость растворимости газа от давления.
- •4.Способы удаления растворённых газов.
- •5.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •6.Совершенные растворы. Построение их диаграммы «давление – состав».
- •7. Связь между жидкой и паровой фазами.
- •8. Причины отклонения давления паров над раствором от з-на Рауля.
- •9.Диаграммы давление –состав и температура – состав для ревльных растворов
- •11.Методы разделения смесей. Ректификация.
- •13 Термодинамическое док-во II з-на Кановалова
- •14.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15 Гетероазеатроп. Перегонка с водяным паром.
- •18. Закон распределения Шилова-Нернста. Экстракция.
- •24. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •25. Основные положения теории сильных электролитов
- •26. Что такое ионная атмосфера, релаксационное и электрофоретическое торможение?
- •28. Активности и коэффициенты активностей электролитов. Методы их определения и вычисления.
- •30. Причина появления электродных потенциалов.
- •31. Термодинамический вывод уравнения для определения электродного потенциала.
- •32 Виды гэ
- •33 Вычисление эдс обратимого гэ, химического или концентрационного
- •37. Электрохимические методы определения рН растворов.
- •38. Потенциометрическое титрование.
- •39. Определение понятий:
- •40. Вывод уравнения кинетики односторонней реакции 1 и 2 порядка.
- •41. Вывод уравнения кинетики двусторонней реакции 1 порядка.
- •42. Вывод уравнения кинетики параллельных односторонних реакций
- •1 Порядка.
- •43. Кинетические кривые и уравнения скорости последовательной реакции.
- •44. Методы определения порядков реакции.
- •45. Методы определения энергии активации.
- •46. Зависимость константы скорости реакции от температуры.
- •47. Вычисление константы скорости бимолекулярной реакции по числу соударений.
- •48. Основные теории переходного состояния.
- •49. Связь константы скорости реакции с энтальпией и энтропией активации.
- •50. Основные законы Фотохимии. Кинетика фотохимической реакции.
- •52. Цепные реакции (примеры, основные признаки).
- •53. Кинетика неразветвленных цепных реакций.
- •54. Принцип стационарности как метод для вывода кинетических уравнений цепных реакций.
- •55.Понятие о пределах воспламенения и взрыва.3 предела взрыва.
- •65.(1)Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •66.Что называется носителем, промотором, активным центром?
- •67.Уравнение динамики нестационарных процессов.
- •68.Уравнение кинетики односторонней р-ции, проводимой в реакторе идеального вытеснения.
- •69.Кинетика гомогенных реакций, проводимых в условиях идеального перемешивания.
- •72. Влияние природы растворителя и давления на скорость химической реакции, проводимой в растворе.
- •Если график зависимости lnk от давления прямая,то δv не зависит от давления.
- •73.Кинетика гетерогенных каталитических реакций, которые тормозятся продуктами реакции.
- •74.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
18. Закон распределения Шилова-Нернста. Экстракция.
Если к двум несмешивающимся жидкостям добавить третий компонент, растворимый в обеих жид-ях, то он распределится между ними в определённом количественном соотношении. Это соотношение есть величина постоянная и называется термодинамическая коэффициентом распределения K:
При равновесии хим. Потенциал третьей жидкости в 2-х фазах будет одинаклов
μI3=μII3
Химический потенциалзависит от активности 3-го компонента в р-ре.
μ3 = μº3+ RT ln а3
μº(I)3+ RT ln а(I)3 = μº(II)3+ RT ln а(II)3
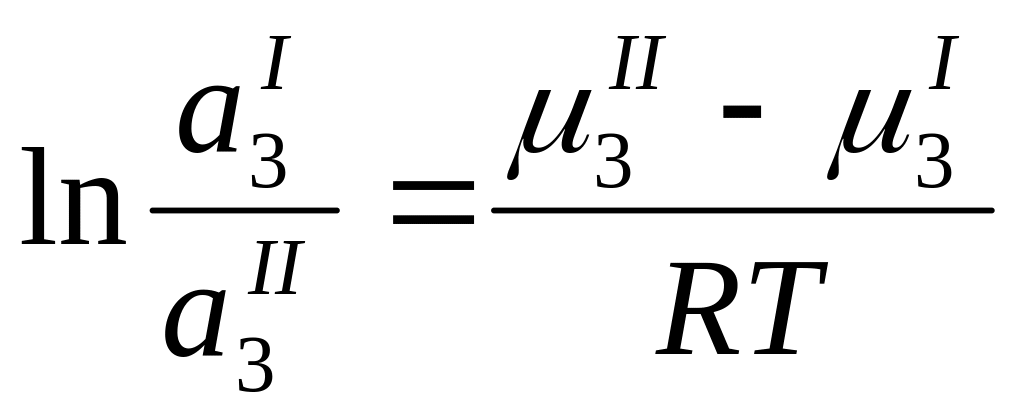
При Т=const
![]() ,
,
где
![]() -
равновесная концентрация распределяющихся
ве-в и в первой и во второй жидких фазах.
-
равновесная концентрация распределяющихся
ве-в и в первой и во второй жидких фазах.
Уравнение называется законом распределения Нернста: распределение каждого из растворённых ве-в между двумя фазами определяется коэф-ом распределения, величина кот-го не зависит от присутствия других ве-в.
Коэф. распределения меняется с изменением конц. Распред-го вещ-ва в 2-х равновесных жидких фазах.
Важным следствием этого закона является экстрагирование, т.е. извлечение ве-ва из р-ра подходящим растворителем, который не смешивается с другим компонентом р-ра. С помощью экстракции можно разделять несколько веществ. Для увеличения полноты извлечения вещ-ва из водного слоя орг.растворителем экстрагирование проводят последовательно небольшими порциями экстрагента (υ), при этом чем больше число последовательных стадий извлечения (n), тем больше полнота извлечения при одном и том же кол-ве взятого экстрагента.
![]()
![]()
где V1-объем экстрагируемого раствора;V2-объем экстрагента; m0- масса компонента в исходной смеси и после первой экстракции осталось m1;
После n
экстракций в первом растворе останется
вещества

При экстракции
одним общим объемом, равным nV2,
масса вещества, которая останется в
экстрагируемом растворе согласно Ур-ю
![]()
Из Ур-й следует, что экстрагирование n раз более эффективно, чем проведение одной экстракции тем же общим объемом экстрагента.
![]()
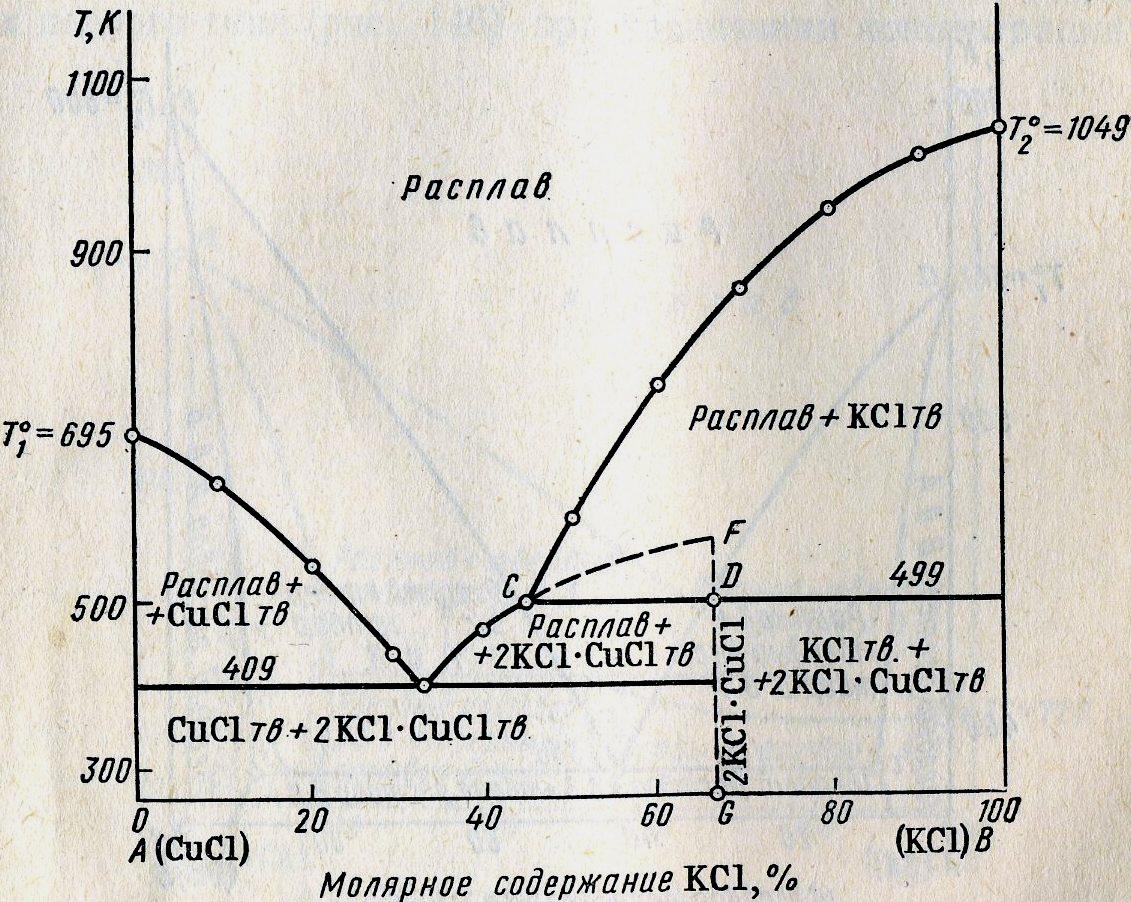
19.Диаграмма плавкости 2-х компонентных систем.
Диаграмма плавкости выражает зависимость температур плавления смесей от их состава. Частным случаем диаграмм плавкости являются диаграммы растворимости, представляющие зависимость растворимости твердых веществ в жидкости от температуры.
Состояние двухкомпонентной сист. определяется 3 параметрами (температура, давление и концентрация одного из компонентов)
Системы без образования химических соединений
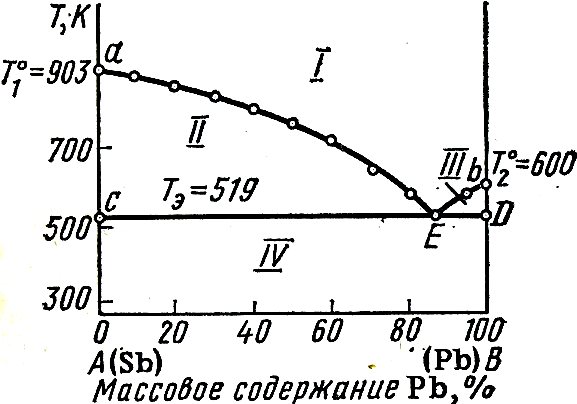
I - жидкий расплав (С=2-1+1=2);
II - жидкий расплав и кристаллы комп-та А (С=
=2-2+1=1);
III - жидкий расплав и кристалы
Компонента В (С=2-2+1=1);
IV - кристалы А и В (С=2-2+1=1);
Линия aEb называется линией ликвидуса – составы жидких расплавов, при охлаждении которых до данной температуры начинается кристаллизация из расплава чистого компонента А или В.
Линия СED линией солидуса, ниже нее жидкость не может существовать.
Точка E называется эвтектической точкой – она соответствует расплаву, который одновременно находится в равновесии с кристаллам компонента А и В. Расплав этот называется эвтектическим, а смесь выпадающих кристаллов при Tэ эвтектикой. Эвтектика кристаллизуется при постоянной температуре – система условно инвариантна, т.к. при изменении давления меняется и температура плавления и состав эвтектики. При кристаллизации эвтектики состав жидкого расплава отличается от состава каждой из равновесных с ним твердых фаз.
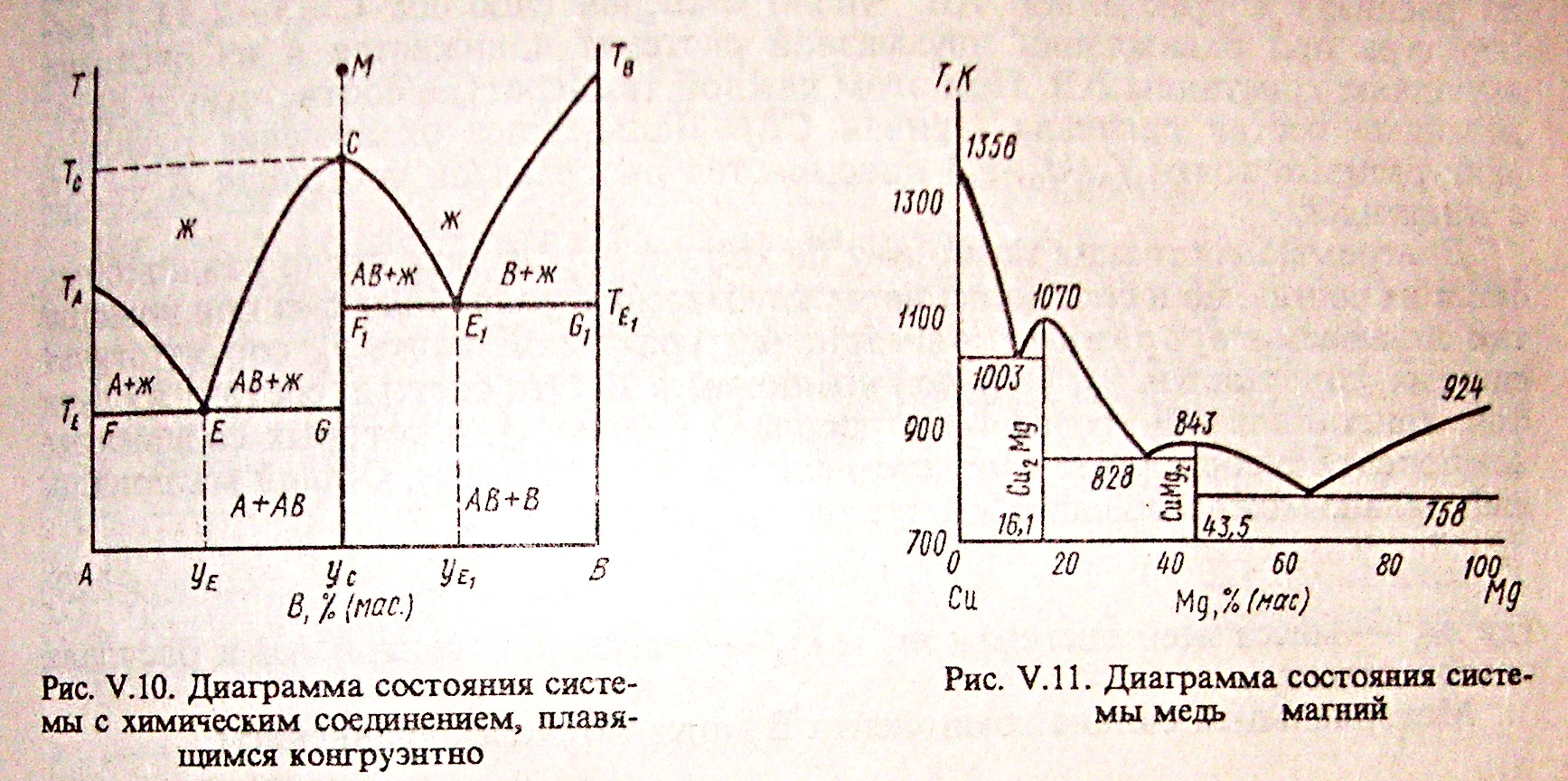
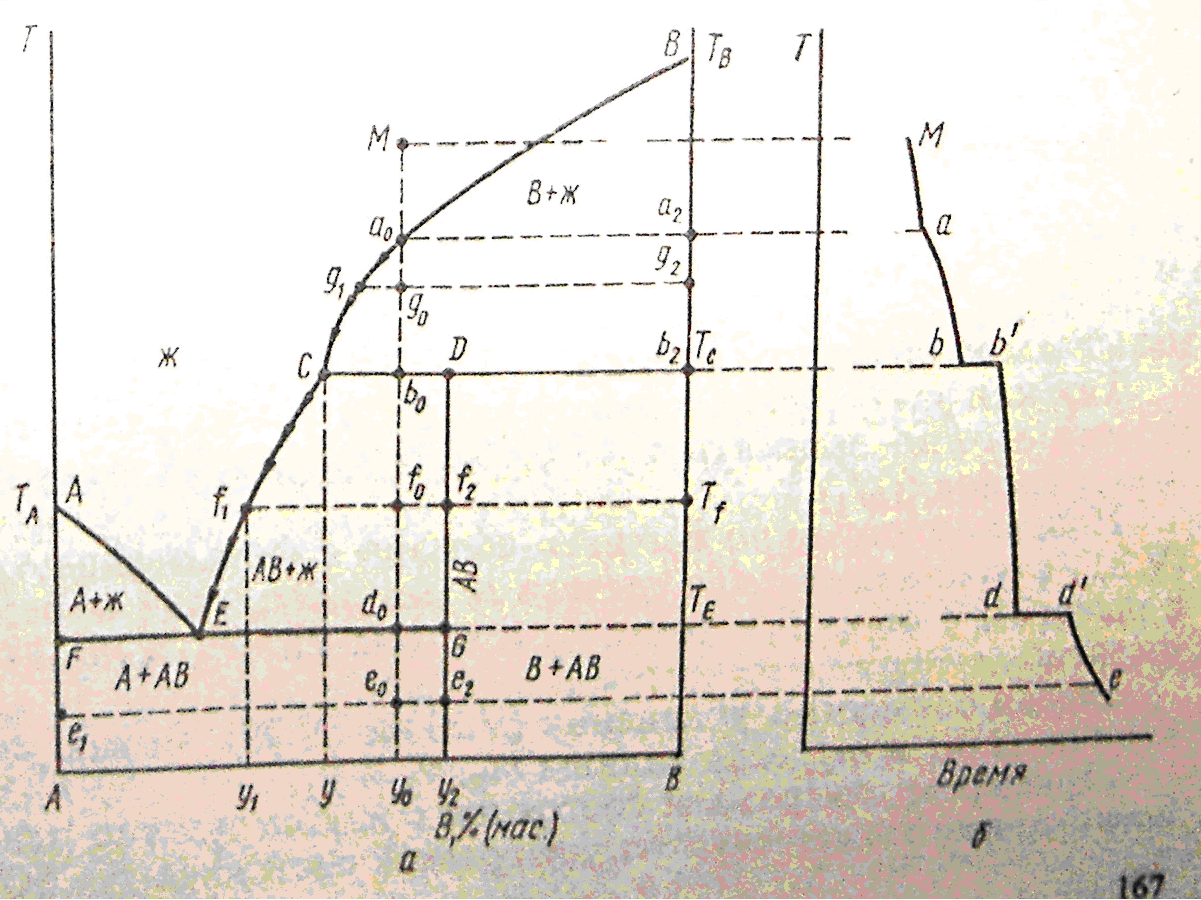
20(1).Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
Если компоненты А и В могут образовывать тв. хим. соединение АВ, плавящееся без разложения, т.е. конгруэнтно, то на диаграмме состояния кривая ликвидуса образует максимумы в точке С, когда состав кристаллической фазы совпадает с составом жид. фазы. По обе стороны от точки С нах-ся эвтектики Е и Е1. Если состав системы находится между чистым компонентом А и химическим соединением АВ, то при эвтектической температуре ТЕ, расплав состава уЕ сосуществует с кристаллами А и АВ. Если состав системы лежит между хим. соед. АВ и компонентом В, то при ТЕ1 расплав состава уЕ1 сосуществует с кристаллами АВ и В. Т.о. рассмотренная диаграмма состояния – сочетание 2-х диаграмм состояния с эвтектикой А – АВ и АВ – В.
Процесс охлаждения расплава, заданного точкой М. При этом составе число независимых комп-ов = 1, т.к. система может быть образована только из одного хим. соед. АВ. При ТС из расплава выпадают кристаллы АВ (Ф=2) и число степ. своб. С=1-2+1=0, т.е. система безвариантна и кристаллизуется при постоянной температуре.
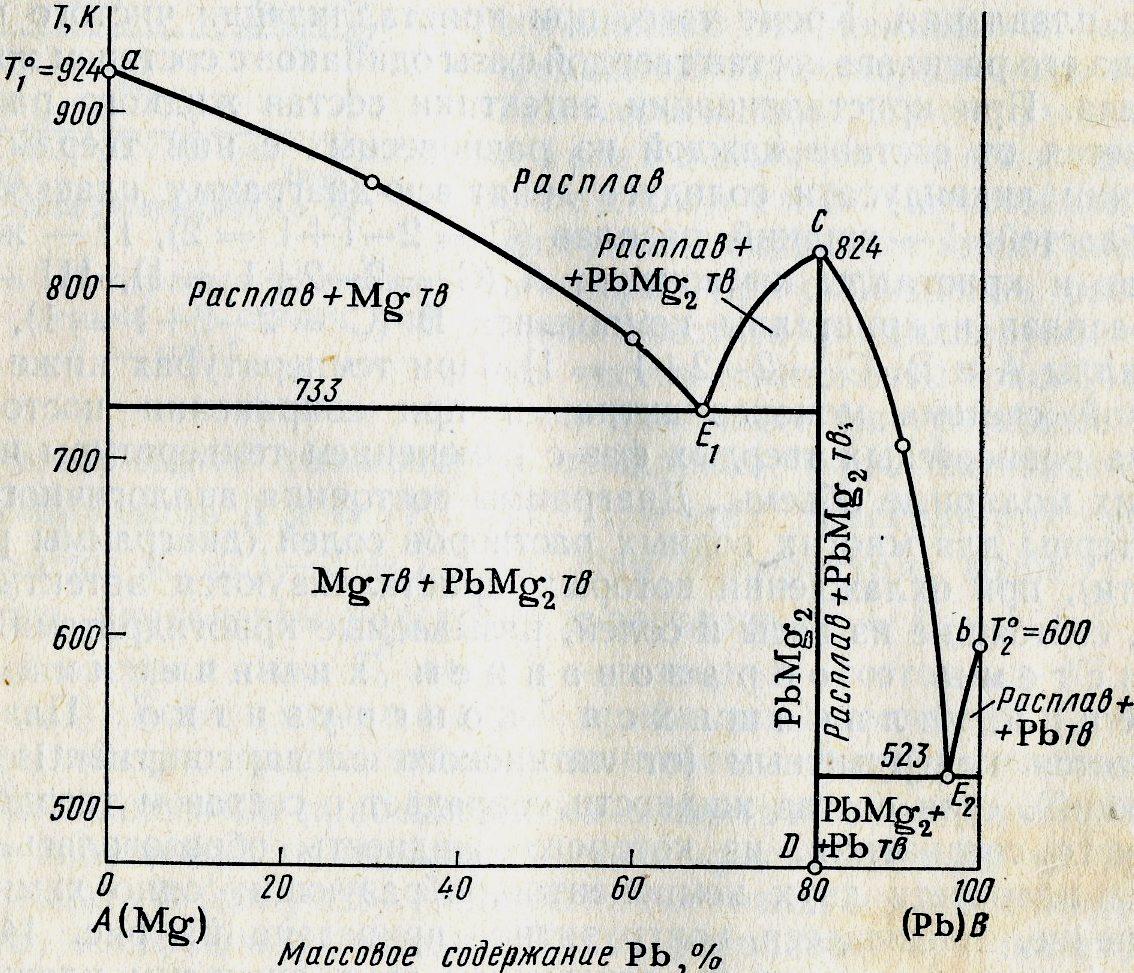
20(2)
Хим. соед-ия при достижении определенной температуры начинают плавиться, распадаясь на кристаллическую и жидкую фазы, составы которых не совпадают. Если компоненты А и В образуют твердое химическое соединение АВ, плавящееся с разложением, т.е. инконгруэнтно, то АВ устойчиво только ниже ТС. При малейшем ↑ t-ры это твердое соединение распадается и образуются 2 фазы: кристаллы В и расплав состава у (точка С).При охлаждении расплава состава М в точке а0 начнется выделение кристаллов компонента В. В интервале температур от а0 до b0 сист. явл. 2-х фазной и одновариантной: С=2-2+1=1. В точке b0 при ТС начинается и продолжается кристаллизация соединение АВ, состав которого соответствует у2 (т. D). В равновесии 3 фазы: расплав, кристаллы АВ и В. С=2-3+1=0 – постоянство ТС, состава раствора у (т. С) и состава хим. соединения у2 (т.D).
Чтобы состав расплава не изменялся, одновременно с кристаллизацией АВ ранее выпавшие кристаллы В должны раств-ся, поддерживая постоянным соединение компонента В в расплаве. Т. С наз-ся перитектикой (переходной), ТС - перитектическая температура. В этой точке находятся в равновесии расплав и 2 тверд. фазы, но в отличается от эвтектики, (где одновременно выпадают 2 тв. фазы) одна тв. фаза выпадает, а другая растворяется. На кривой охлаждения наблюдается горизонтальный участок (bb’).
Процесс охлаждения в точке b0 заканчивается растворением всех ранее выпавших кристаллов В. Остается 2-х фазная система, состоящая из расплава и кристаллов АВ. При этом каждой температуре соответствует определенный состав расплава (СЕ). Дальнейшее охлаждение описывается диаграммой состояния А-АВ с эвтектикой.
21. Дифферинциальный термический анализ (ДТА)
ДТА – это нахождение зависимости между температурой плавления вещества и его свойствами.Метод позволяет изучать фазовый состав Ме систем, природных минералов, устанавливать тем-ые границы сущ-ия многих соединений (соли, полимеры), определять теплоты фазовых превращений, теплопров-ть, теплоемкость.
Метод основан на автоматической записи дифференциальной термопарой термограмм – кривых ∆Т – Т, где ∆Т – разность температур м/у исследуемым веществом и эталоном, нагреваемых или охлаждаемых в одинаковых условиях; Т – температура образца или время нагревания/охлаждения. Эталон – в-во, не имеющее фазовых превращений в исследуемом интервале температур.
Вид термограммы исследуемого в-ва зависит от свойств самого в-ва (состав, структура, теплопроводность, теплоемкость, дисперсность и др.) и от условий снятия термограммы (скорость нагревания, величина навески, плотность набития в-ва в тигле, положения спая в образце и в эталоне, свойства эталона, чувствительность в цепи дифференциальной термопары).
- если теплофизические св-ва эталона и исследуемого в-ва совпадают и последнее при нагревании не испытывает никаких превращений, то ∆Т=0, и термограмма им. вид прямой линии (1) – нулевая линия;
- если исследуемое в-во отличается от эталона своими теплофизическими свойствами, то термограмма (2) отклонится от нулевой линии и регистрируется || оси абсцисс или под углом к ней – базисная линия.
- если в процессе нагревания в образце происходит при к.-л. температуре фазовое превращение или хим. изменение с выделением или поглощением теплоты, то возникает ∆Т, пропорционально кол-ву поглощенной/выделенной теплоты. Возникшая разность температур регистрируется отклонением кривой ДТА вверх или вниз от базисной линии (3) – термический эффект. Согласно методике, отклонение ↑ - экзотермический, ↓ - эндотермический эффект.
Экзотермические эффекты (с выделением Q) могут быть обусловлены переходом из неравновесного состояния в равновесное, наприм. переход из аморфного состояния в кристаллическое.
Эндотермические эффекты (с поглощением Q) связаны с фазовыми превращениями (плавление, испарение, возгонка, полиморфные превращения) или химическими процессами (окисление, разложение, дегидратация, диссоциация и др.). При нагревании большинства веществ наблюдается несколько превращений, которые регистрируются на кривой ДТА при соответствующих температурах термическими эффектами, характерными для данного в-ва.
По термограмме можно дать качественную характеристику исследуемому в-ву, определить температуры фазовых превращений или химических процессов, измерить тепловой эффект процесса.
∆Т
Т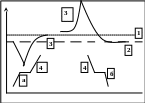
22.Понятия:
Удельная электропроводность жидкости χ - это электропроводность 1 см3 раствора, заполняющего пространство между плоскими электродами одинаковой, оч. большой площади ( в см2), находящимися на расстоянии 1см.
- Зависит от природы элек-та и раст-ля, от концентрации р-ра, от Т.
- При ↑ кон-ции слаб. элек-та, χ ↓
- При ↑ кон-ции сильн. элек-та, сначала ↑ затем ↓.
- При ↑ Т, χ ↑.
Эквивалентная электропроводность λ – это электропроводность такого объема (см3) раствора в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга. [см2/г-экв*ом]
![]()
где φ – разведение, [см3/г-экв]
с – эквивалентная концентрация, [г-экв/л]К
- При ↓ кон-ции р-ра элек-та, λ ↑;
- λ=мах будет при бесконеч. разбавлении
Эмпирическая формула Кольрауша:
λ=λ∞-А√с
Скорость движения иона (vi,ui – скорости движения А- и К+ соответственно) определяется силой, действующей на ион, кот. равна произведению заряда иона на градиент потенциала поля, и фактором R, характеризующим сопротивление среды, зависящей от T, природы иона и раств-ля
![]() zi
– заряд иона; E/l
– напряженность поля, градиент поля
zi
– заряд иона; E/l
– напряженность поля, градиент поля
Зависит от: природы ионов, Е\l, концентрации, температуры, вязкости среды.
Аналогично для ui
Абсолют. Скорость движ. ионов применяется при сравнении скоростей ионов, если напряженность поля =1 в/см
v=ezi/R (то же для u)
Подвижность ионов – кол-во электр-ва, переносящееся ионом равно произведению абсолютной скорости ионов на число Фарадея.
V=v*F и U=u*F
Число переноса ионов i-го вида – отношение кол-ва электр-ва qi (зависит от zi, конц., скорости движения в электрическом поле), перенесен. данным видом ионов, к общему кол-ву электр-ва q, перенесен. всеми видами ионов, находящихся в р-ре ti=qi/q.
Ионная сила р-ра (ионная крепкость) называется полусумма произв-ний кон-ций каждого иона на квадрат числа его зарядов z (валентность), взятая для всех ионов р-ра.
I = ½ ∑mizi2
где mi – молярность (мера концентрации)
Эмпирический закон ионной силы:
Сред. ионный коэф. активности γ+/- явл. универсальной функцией ионной силы I р-ра, т.е. в р-ре с данной ионной силой все диссоциирующие в-ва им. коэф-ты активности, не зависящие от природы и концентрации данного в-ва, но зависящие от числа и валентности его ионов.
23. Факторы, влияющие на электропроводность растворов, скорости движения и подвижность ионов.
1. природа иона
2. напряженность поля E/l
3. концентрации. (уд. э\проводность на графике ae=f(с,моль\л)- радуга; экв.э\проводность λ=с,г*экв\л – горка вогнутая к 0, вниз.
4. температуры (с ней растут уд.э\проводность и предел подвижности, у металлов наоборот)
5. вязкости среды
