
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Зависимость растворимости газа от давления.
- •4.Способы удаления растворённых газов.
- •5.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •6.Совершенные растворы. Построение их диаграммы «давление – состав».
- •7. Связь между жидкой и паровой фазами.
- •8. Причины отклонения давления паров над раствором от з-на Рауля.
- •9.Диаграммы давление –состав и температура – состав для ревльных растворов
- •11.Методы разделения смесей. Ректификация.
- •13 Термодинамическое док-во II з-на Кановалова
- •14.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15 Гетероазеатроп. Перегонка с водяным паром.
- •18. Закон распределения Шилова-Нернста. Экстракция.
- •24. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •25. Основные положения теории сильных электролитов
- •26. Что такое ионная атмосфера, релаксационное и электрофоретическое торможение?
- •28. Активности и коэффициенты активностей электролитов. Методы их определения и вычисления.
- •30. Причина появления электродных потенциалов.
- •31. Термодинамический вывод уравнения для определения электродного потенциала.
- •32 Виды гэ
- •33 Вычисление эдс обратимого гэ, химического или концентрационного
- •37. Электрохимические методы определения рН растворов.
- •38. Потенциометрическое титрование.
- •39. Определение понятий:
- •40. Вывод уравнения кинетики односторонней реакции 1 и 2 порядка.
- •41. Вывод уравнения кинетики двусторонней реакции 1 порядка.
- •42. Вывод уравнения кинетики параллельных односторонних реакций
- •1 Порядка.
- •43. Кинетические кривые и уравнения скорости последовательной реакции.
- •44. Методы определения порядков реакции.
- •45. Методы определения энергии активации.
- •46. Зависимость константы скорости реакции от температуры.
- •47. Вычисление константы скорости бимолекулярной реакции по числу соударений.
- •48. Основные теории переходного состояния.
- •49. Связь константы скорости реакции с энтальпией и энтропией активации.
- •50. Основные законы Фотохимии. Кинетика фотохимической реакции.
- •52. Цепные реакции (примеры, основные признаки).
- •53. Кинетика неразветвленных цепных реакций.
- •54. Принцип стационарности как метод для вывода кинетических уравнений цепных реакций.
- •55.Понятие о пределах воспламенения и взрыва.3 предела взрыва.
- •65.(1)Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •66.Что называется носителем, промотором, активным центром?
- •67.Уравнение динамики нестационарных процессов.
- •68.Уравнение кинетики односторонней р-ции, проводимой в реакторе идеального вытеснения.
- •69.Кинетика гомогенных реакций, проводимых в условиях идеального перемешивания.
- •72. Влияние природы растворителя и давления на скорость химической реакции, проводимой в растворе.
- •Если график зависимости lnk от давления прямая,то δv не зависит от давления.
- •73.Кинетика гетерогенных каталитических реакций, которые тормозятся продуктами реакции.
- •74.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
11.Методы разделения смесей. Ректификация.
Автоматизированный процесс, приводящий к разделению жидкого раствора наз-ся ректификацией.
Разделение смеси ведется в ректификационной калонне.
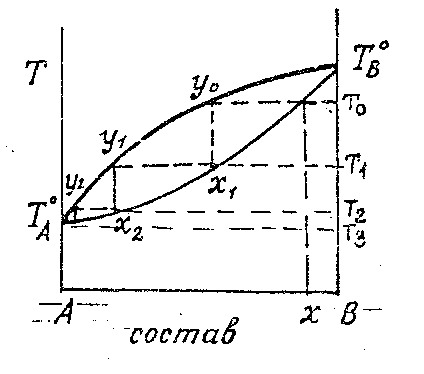
Последовательность разделения сложной смеси у/в можно рассмотреть с помощью диаграммы. В начале жидкость состава х0 нагревается до температуры кипения Т0 .При этой температуре выделяется из жидкости пар состава у0. Этот пар, проходя через патрубок, вступает в контакт с жидкостью (флегмой) на тарелке при Т1<Т0. При конденсации пара состава у0 в жидкости на I-ой тарелке выделяется теплота конденсации, за счет которой из жидкости состава х1 на этой тарелке выделяется пар состава у1. Этот пар обогащен более НК компонентом (у1>y0). Пар состава у0 конденсируется в жидкость состава х1. Пар состава у1 поступает на 2-ю тарелку, где часть его конденсируется в жидкость состава х2, и за счет теплоты конденсации выделяется пар состава у2 при температуре Т2 и.т.д.
Температура в верхней части колонны снижается в ряду :
Т0>T1>T2>T3>T4. Число ступенек на диаграмме температура-состав опред. число тарелок, кот. необходимо разместить в колонне для разделения раствора на отдельные компоненты. Разделяющая способность зависит от относительной летучести компонентов (чем α боьше тем разделение идет лучше ),от конструкции тарелок .
12. 2й з-н Коновалова.
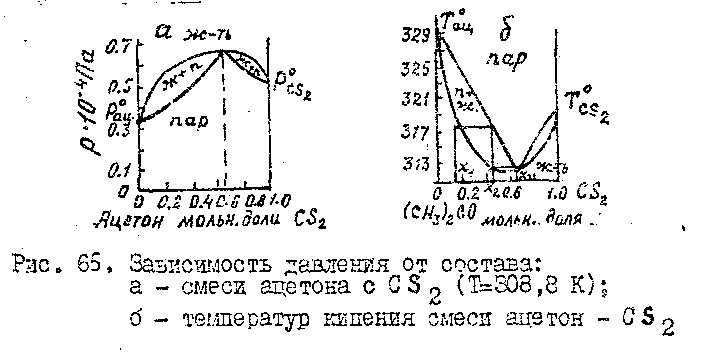
Жидкости, имеющие максимум или минимум на кривых давление -состав соответствуют минимумы и максимумы на кривых Ткип – состав, причем в точках минимума и максимума составы жидкой и паровой фазы равны.
Отклонение свойств реальных растворов от св-в идеальных могут быть настолько большими, что кривые давления насыщенного пара или Ткип в зависимости от состава раствора могут иметь максимум или минимум давлении температуры кипения.
* еще
два графика, но наоборот, т.е минимум
давление, максимум температура
еще
два графика, но наоборот, т.е минимум
давление, максимум температура
Максимум на кривых давление – состав появляется у р-ров жидкостей, полиэдры кот. однородного состава более прочны, чем полиэдры разнородного состава, и наоборот. В точках максимума или минимума давлений или Ткип составы жидкой и паровой фаз равны (х=у). Смеси такого состава называются азеатропами или неразделяющимися.
При разгонке азеатропов с максимумом Ткип в отгоне будут содержаться жид-ть А или В, а в остатке –азеатроп, содержащий оба компонента (А+В). При разгонке жидкостей с минимумом Ткип с парами будет уходить из разгоночного аппарата азеатроп, а в остатке будет содержаться один из компонентов.
Методы разделения гетероазеатропных смесей:
1) Химический метод разделения азеатропа (вода+спирт ,с добавлением водоотнимающего агента, например СаО )
2) Разгонка в колоннах под вакуумом.
3) Разделение азеатропа путем перегонки с добавлением третьего компонента.(К раствору вода+спирт добавляем бензол .образуется двухслойная жидкость,кипящая при 64 ºС и давлении 1 атм. Остаток после отгонки бензольного раствора явл. абс. спирт).
13 Термодинамическое док-во II з-на Кановалова
Жидкости, имеющие максимум или минимум на кривых давление -состав соответствуют минимумы и максимумы на кривых Ткип – состав, причем в точкх минимума и максимума составы жидкой и паровой фазы равны.
Док-во: исходя из уравнения Гиббса - Дюгема, которое для бинарной смеси жидкостей на небольшом удалении от экстремума можно записать в таком виде.
Подставляем в это выражение
Х1=1-Х2 :
Выделяем из dp1 :
Давление p1 и р2 по з-ну Дальтона можно связать с составом паровой фазы:
р1=(1-у2)Р и р2=у2Р
Подставляем в предыдущее уравнение:
Полное давление по з-ну Дальтона равно сумме парциальных давлений:
Р=р1+ р2
Дифференцируем dP=dp1 +dp2
Поделим на dx2
В точке экстремума
![]()
И кроме того первая производная
![]()
Откуда
![]()
![]()
Это равенство выполняется при условии, что у2=х2 ,что и требовалось доказать.
