
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Зависимость растворимости газа от давления.
- •4.Способы удаления растворённых газов.
- •5.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •6.Совершенные растворы. Построение их диаграммы «давление – состав».
- •7. Связь между жидкой и паровой фазами.
- •8. Причины отклонения давления паров над раствором от з-на Рауля.
- •9.Диаграммы давление –состав и температура – состав для ревльных растворов
- •11.Методы разделения смесей. Ректификация.
- •13 Термодинамическое док-во II з-на Кановалова
- •14.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15 Гетероазеатроп. Перегонка с водяным паром.
- •18. Закон распределения Шилова-Нернста. Экстракция.
- •24. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •25. Основные положения теории сильных электролитов
- •26. Что такое ионная атмосфера, релаксационное и электрофоретическое торможение?
- •28. Активности и коэффициенты активностей электролитов. Методы их определения и вычисления.
- •30. Причина появления электродных потенциалов.
- •31. Термодинамический вывод уравнения для определения электродного потенциала.
- •32 Виды гэ
- •33 Вычисление эдс обратимого гэ, химического или концентрационного
- •37. Электрохимические методы определения рН растворов.
- •38. Потенциометрическое титрование.
- •39. Определение понятий:
- •40. Вывод уравнения кинетики односторонней реакции 1 и 2 порядка.
- •41. Вывод уравнения кинетики двусторонней реакции 1 порядка.
- •42. Вывод уравнения кинетики параллельных односторонних реакций
- •1 Порядка.
- •43. Кинетические кривые и уравнения скорости последовательной реакции.
- •44. Методы определения порядков реакции.
- •45. Методы определения энергии активации.
- •46. Зависимость константы скорости реакции от температуры.
- •47. Вычисление константы скорости бимолекулярной реакции по числу соударений.
- •48. Основные теории переходного состояния.
- •49. Связь константы скорости реакции с энтальпией и энтропией активации.
- •50. Основные законы Фотохимии. Кинетика фотохимической реакции.
- •52. Цепные реакции (примеры, основные признаки).
- •53. Кинетика неразветвленных цепных реакций.
- •54. Принцип стационарности как метод для вывода кинетических уравнений цепных реакций.
- •55.Понятие о пределах воспламенения и взрыва.3 предела взрыва.
- •65.(1)Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •66.Что называется носителем, промотором, активным центром?
- •67.Уравнение динамики нестационарных процессов.
- •68.Уравнение кинетики односторонней р-ции, проводимой в реакторе идеального вытеснения.
- •69.Кинетика гомогенных реакций, проводимых в условиях идеального перемешивания.
- •72. Влияние природы растворителя и давления на скорость химической реакции, проводимой в растворе.
- •Если график зависимости lnk от давления прямая,то δv не зависит от давления.
- •73.Кинетика гетерогенных каталитических реакций, которые тормозятся продуктами реакции.
- •74.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
8. Причины отклонения давления паров над раствором от з-на Рауля.
При образовании раствора, когда в чистый раст-ль вводится растворенное вещество,появляется новая структура с иным расположением частиц,чем в чистом растворителе,которая будет зависеть от состава раствора и будет специфична для каждого раствора.Изменяются и силы ММВ.В растворе кроме взаимодействия между однородными молекулами появляется взаимодействие и между разнородными частицами.Частицы растворенного вещества взаимодействуют друг с другом и с мол-ми раст-ля.Это является причиной отклонения давления паров над раствором от з-на Рауля.
«+» и «-» отклонения обусловлены разными факторами:
Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, т.е. FA-B < FA-A, то это облегчит переход из жидкой фазы в паровую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения.
Усиление взаимного притяжения в разнородных молекулах (сольватация, водородная связь, образование химического соединения) затрудняет переход в газовую фазу и будут наблюдаться отрицательные отклонения.
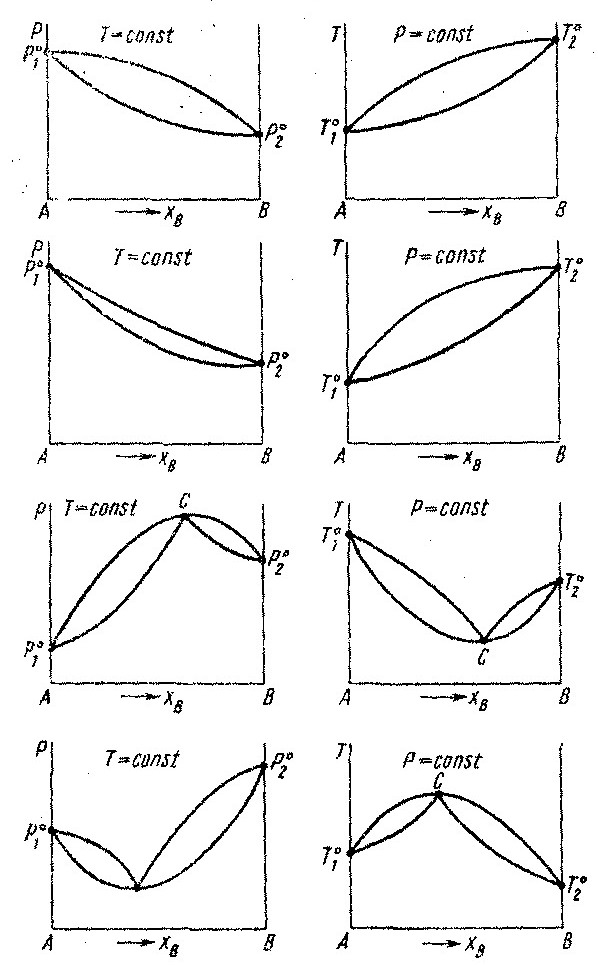
9.Диаграммы давление –состав и температура – состав для ревльных растворов
I)
II)
III)
IV)
I – Растворы с незначительными положительными отклонениями.
II – Растворы с незначительными отрицательными отклонениями.
III – Расворы со значительными положительными отклонениями.
IV – Растворы со значительными отрицательными отклоненями.
«+» и «-» отклонения обусловлены разными факторами:
Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, т.е. FA-B < FA-A, то это облегчит переход из жидкой фазы в паровую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения.
Усиление взаимного притяжения в разнородных молекулах (сольватация, водородная связь, образование химического соединения) затрудняет переход в газовую фазу и будут наблюдаться отрицательные отклонения.
Растворы со значительными положительными или отрицательными отклонениями от идеальности способны образовывать азеотропные смеси, которые на диаграммах состояния изображены точкой с. Азеотропные смеси – это растворы при испарении которых получается пар того же состава, что и исходная жидкая смесь. В реальных растворах азеотропная смесь имеет самую низкую или самую высокую температуру кипения.При изменении внешнего давления изменяется не только Ткип,но и состав азеотропного раствора, т.е. азеотропная смесь не является хим. соединением. Азеотропные смеси образуются не только в системах со значительными отклонениями от з-на Рауля,но и в системах с незначительными отклонениями,если компоненты раствора имеют близкие Ткип, т.е. почти одинаковые давления пара над чистыми компонентами. В этом случае на диаграмме состояния появляется экстремум, лежащий в средней части диаграммы.Чем больше различие между Р01 и Р02 тем больше положение экстремума сдвинутов сторону одного из компонентов:при максимуме – в сторону более летучего;при минимуме – в сторону менее летучего.
10.Первый з-н Канавалова
Пар над смесью 2х летучих жидкостей относительно богаче тем из компонентов, прибавление которого к смеси повышает общее давление пара при данной температуре или понижает температуру кипения.
Графическое доказательство
На основе рис. Можно показать, что в паровой фазе содержится больше НКК, чем в жидкой фазе, находящейся в равновесии с паровой фазой. Для доказательства этого нагреваем изобарически жидкость состава х1 до температуры кипения Тк. При этой температуре жид-ть испаряется и образуется пар состава у1, который при конденсации образует жидкость состава х2. Из рисунка следует, что у2 > у1, то есть в паровой фазе НКК содержится больше, чем в жидкой фазе. Следовательно, в паре содержится больше того компонента, который кипит при более низкой температуре.
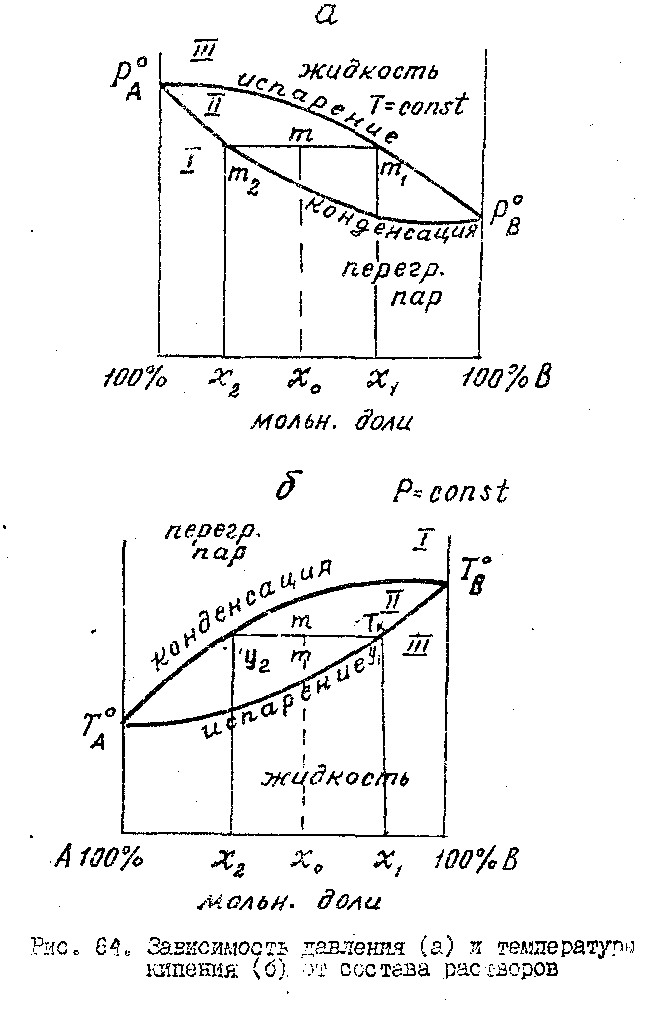
I – область пара, II – область жидкости, III – область равновесия пара и ж-ти.
Термодинамический вывод: исходя из уравнения Гиббса - Дюгема, которое для бинарной смеси жидкостей на небольшом удалении от экстремума можно записать в таком виде.
![]()
Подставляем в это выражение
Х1=1-Х2 :
![]()
Выделяем из dp1 :
![]()
Давление p1 и р2 по з-ну Дальтона можно связать с составом паровой фазы:
р1=(1-у2)Р и р2=у2Р
Подставляем в предыдущее уравнение:
![]()
Полное давление по з-ну Дальтона равно сумме парциальных давлений:
Р=р1+ р2
Дифференцируем dP=dp1 +dp2
![]()
Поделим на dx2
![]()
