
- •Оглавление
- •Предисловие
- •Введение
- •Раздел I. Химия почв
- •1. Химический состав почв
- •1.1. Элементный состав почв
- •1.2. Фазовый состав почвы
- •1.3. Соединения щелочных и щелочно-земельных элементов в почвах
- •1.4. Формы соединений химических элементов в почвах и их доступность растениям
- •Контрольные вопросы
- •2. Почвенные растворы
- •2.1. Концентрации и активности ионов и солей в почвенных растворах
- •2.2. Методы определения активности ионов
- •Контрольные вопросы
- •3. Катионообменная способность почв
- •3.1. Селективность катионного обмена
- •3.2. Кинетика обмена катионов
- •3.3. Уравнения и изотермы катионного обмена
- •3.4. Катионный обмен и адсорбция
- •3.5. Обменные катионы в почвах
- •Контрольные вопросы
- •4. Окислительно-восстановительные реакции и процессы в почвах
- •4.1. Окислительно-восстановительный потенциал почвы
- •4.2. Потенциалопределяющие системы в почвах
- •4.3. Окислительное состояние основных типов почв
- •4.4. Типы окислительно-восстановительных режимов
- •4.5. Влияние окислительно-восстановительных процессов на химическое состояние почв
- •4.6. Методы определения окислительных потенциалов и изучения окислительно-восстановительных режимов
- •Контрольные вопросы
- •Раздел II. Физика почв
- •1. Подготовка почвы к определению показателей физических свойств
- •1.1. Заложение и описание почвенного разреза
- •1.2. Морфологическое описание почвенного разреза
- •Пример морфологического описания почвы Разрез № 217
- •Контрольные вопросы
- •2. Определение гранулометрического состава почвы
- •Классификация почв и пород по гранулометрическому составу
- •2.1. Методы определения гранулометрического состава
- •2.1.1 Определение гранулометрического состава визуально и на ощупь
- •Визуальные методы определения гранулометрического
- •2.1.2 Лабораторные методы определения гранулометрического состава
- •Подготовка почвы к гранулометрическому анализу
- •Форма записи при определении гигроскопической влажности почвы
- •Определение гранулометрического состава в стоячей воде. Метод пипетки
- •Плотность и вязкость воды в зависимости от температуры
- •Интервалы во времени при взятии проб суспензии в зависимости от температуры суспензии и плотности частиц
- •Расчёт результатов анализа
- •Пример вычисления:
- •Пример записи данных гранулометрического анализа
- •Контрольные вопросы
- •3. Методы изучения структуры почвы
- •3.1. Морфологическое изучение почвенной структуры
- •3.2. Лабораторные методы изучения структуры почвы
- •3.2.1. Агрегатный анализ почвы (метод сухого рассева)
- •Форма записи результатов агрегатного анализа
- •3.2.2. Определение водопрочности структурных агрегатов по п.И. Андрианову
- •3.2.3. Микроагрегатный анализ
- •Форма записи результатов микроагрегатного анализа
- •3.2.4. Определение порозности агрегатов
- •Форма записи при определении порозности агрегата
- •Контрольные вопросы
- •4. Методы определения показателей общих физических свойств почвы
- •4.1. Определение плотности твёрдой фазы почвы
- •Состав и плотность некоторых минералов
- •Форма записи определения твёрдой фазы почвы
- •4.2. Определение плотности почвы
- •Форма записи определения плотности почвы
- •4.3. Определение пористости (порозности, скважности) почвы
- •4.4 Определение дифференциальной порозности методом расчёта
- •Форма записи определения дифференциальной порозности
- •4.5 Оценка показателей общих физических свойств почвы
- •Характеристика уплотненности почвы по величине плотности сложения (dV, г/см3) и порозности (p, % от объёма почвы)
- •Контрольные вопросы
- •5. Методы изучения водных свойств почвы
- •5.1 Определение влажности почвы
- •5.2 Определение водопроницаемости почвы
- •Оценка водопроницаемости почв тяжёлого гранулометрического состава
- •Форма записи результатов определения водопроницаемости почвы
- •5.3 Определение гидрологических характеристик почвы
- •Максимальная гигроскопичность почв, различных по гранулометрическому составу и средней гумусированности
- •5.4 Определение влагоёмкости почвы
- •Форма записи результатов определения капиллярной влагоёмкости
- •Оценка предельной полевой (наименьшей) влагоёмкости
- •5.5 Расчёты запасов влаги при определении наиболее важных гидрологических характеристик почвы
- •Контрольные вопросы
- •Раздел III. Статистическая обработка данных при изучении свойств почв
- •1. Статистические показатели вариационных рядов
- •Пример расчёта статистических показателей
- •Результаты статистической обработки данных определения плотности лугово-чернозёмной почвы в слое 0 – 20 см
- •2. Оценка существенности разницы выборочных средних
- •Примеры расчётов
- •Влияние использования лугово-чернозёмной почвы на водопрочность структуры
- •3. Корреляция и регрессия
- •Пример расчёта
- •Влажность устойчивого завядания растений при различной плотности пахотного слоя чернозёма обыкновенного
- •Расчет корреляционной зависимости между влажностью устойчивого
- •Слоя чернозёма обыкновенного
- •Заключение
- •Библиографический список
3.4. Катионный обмен и адсорбция
При количественном описании явлений катионного обмена нередко используют уравнения изотерм адсорбции, например уравнения Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассматривают как один из видов адсорбции. Однако различия между адсорбционными явлениями и ионным обменом настолько велики, что на этом следует остановиться подробнее.
Адсорбцией называют концентрирование вещества адсорбата из объема газа или жидкости на поверхности твердого тела (адсорбента) или жидкости. Если молекулы адсорбата образуют поверхностное химическое соединение с адсорбентом, то говорят о хемосорбции. Адсорбция увеличивается с ростом давления газа или концентрации раствора. При снижении парциального давления адсорбируемого компонента газовой смеси или при бесконечном разбавлении раствора адсорбция уменьшается вплоть до полного освобождения поверхности адсорбента от молекул адсорбата. Сухие почвы обладают способностью адсорбировать различные газы и пары. Наиболее интенсивно происходит адсорбция молекул воды, которая описывается уравнением Брунауера – Эммета –Теллера (изотерма БЭТ). В меньшей степени адсорбируются СО2, О2, N2. Адсорбция воды, диоксида углерода и кислорода может сопровождаться химическим взаимодействием с компонентами твердых фаз почв (хемосорбция). Из растворов почвы адсорбируют нейтральные молекулы органических соединений, гумусовые вещества.
Адсорбцию вызывают молекулярные силы поверхности адсорбента. Неполярные молекулы удерживаются за счет дисперсионных сил. Полярные молекулы (диполи, мультиполи) взаимодействуют с электростатическим полем поверхности адсорбента, что усиливает адсорбцию. Одно из главных различий между адсорбцией и ионным обменом заключается в том, что обменные катионы являются обязательным компонентом ППК и могут быть только заменены на катионы другого рода, но не удалены вовсе. Попытка пространственного расчленения ППК на анионную часть и катионы привела бы к нарушению принципа электронейтральности. В противоположность этому поверхность адсорбента может быть полностью лишена молекул адсорбата. Общее содержание обменных катионов остается сравнительно постоянным (в пределах постоянства величины ЕКО), тогда как количество адсорбированного вещества является функцией активности адсорбата в объеме фазы. Иными словами, адсорбент и адсорбат могут существовать раздельно, тогда, как ППК составляет единое целое.
В то же время количественные закономерности адсорбции и
ионного обмена могут быть описаны сходными по форме
уравнениями. Для описания изотерм адсорбции пользуются уравнением Фрейндлиха или уравнением Ленгмюра. Эмпирическое уравнение Фрейндлиха имеет вид:
![]()
где Q – количество адсорбированного вещества; С – его равновесная концентрация (или равновесное парциальное давление); m и n – эмпирические константы. Это уравнение хорошо описывает многие сорбционные процессы, хотя и не позволяет найти предельную величину максимальной адсорбции.
Уравнение Ленгмюра для мономолекулярной адсорбции записывают в следующем виде:
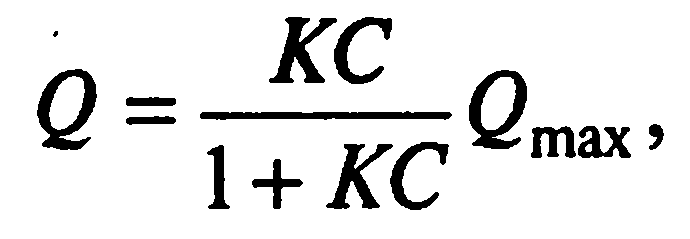
где Q – количество адсорбированного вещества на 1 г адсорбента; С – равновесная концентрация; К– константа равновесия; Qmax – максимальное количество вещества, адсорбируемое адсорбентом, его сорбционная емкость.
Если числитель и знаменатель правой части уравнения разделить на К, получим:
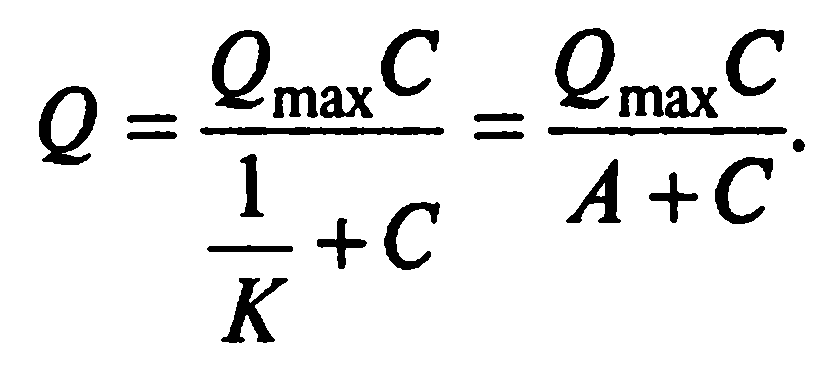
Уравнение Ленгмюра записывают и в несколько иной форме:
![]()
где θ – доля заполнения поверхности адсорбента адсорбатом; α – поверхностная концентрация заполненных адсорбционных мест; αм – общее число адсорбционных мест на поверхности адсорбента.
Уравнения Фрейндлиха и Ленгмюра используют в почвоведении для описания поглощения почвой нейтральных молекул и частиц, несущих электрический заряд. Однако следует иметь в виду, что формальное подчинение какого-либо процесса одному из этих уравнений не позволяет делать выводы о механизмах взаимодействия. В тех случаях, когда количество одного из реагирующих компонентов ограничено (как в случае адсорбционной емкости), количество продукта реакции нарастает по кривой, сходной с изотермой адсорбции. Так, например, происходит реакция осаждения соли со сравнительно высоким произведением растворимости.
Уравнение Ленгмюра можно рассматривать как частный случай закона действия масс, когда свободные адсорбционные центры взаимодействуют с адсорбатом, образуя какое-либо адсорбционное соединение. Поэтому в зависимости от поставленной задачи реакцию поглощения или обмена катионов почвами можно описать с той или иной степенью приближения различными уравнениями. Но решить задачу о механизмах взаимодействия и типах связи только на основе уравнения изотермы практически невозможно.
При изучении процессов поглощения почвами катионов, анионов, неполярных молекул широко используют представление о специфической и неспецифической адсорбции. Различие между ними определяется характером связи поглощенных почвой веществ с активными адсорбционными центрами на поверхностях твердых фаз. Неспецифическая адсорбция обусловлена слабыми молекулярными (вандерваальсовыми) и кулоновскими (электростатическими) силами. Электрическое взаимодействие характерно для классического варианта ионного обмена, когда удерживаемые за счет электростатического взаимодействия катионы и анионы легко обмениваются на катионы и анионы равновесного почвенного раствора. Такое взаимодействие характерно в чистом виде для катионов Na+, Cs+, частично для К+, Са2+, Mg2+, Ва2+, а также для анионов Сl- и NO3.
Большинство анионов (Н2РО4-, HPO42-, SO42-, SeO42-, F-), катионы щелочно-земельных металлов и гидроксиды практически всех тяжелых металлов в значительной мере или полностью поглощаются по механизму специфической адсорбции. Это означает, что при таком взаимодействии образуются значительно более прочные координационные и ковалентные связи с поверхностными соединениями или группами. Иногда отмечают, что хемосорбция отличается образованием еще более прочных связей. Связанные по механизму специфической адсорбции ионы не удается вытеснить катионами и анионами нейтральных солей по типу обычных реакций ионного обмена. При специфической адсорбции может поглощаться значительно большее количество ионов, чем это вытекает из ЕКО и уравнений обмена, причем уровень поглощения сильно зависит от рН.
Специфически могут связываться ионы К+ и NH4+, в том числе в межпакетных пространствах минералов с расширяющейся решеткой, а также гидроксокомплексы катионов многих металлов.
