
- •Оглавление
- •Предисловие
- •Введение
- •Раздел I. Химия почв
- •1. Химический состав почв
- •1.1. Элементный состав почв
- •1.2. Фазовый состав почвы
- •1.3. Соединения щелочных и щелочно-земельных элементов в почвах
- •1.4. Формы соединений химических элементов в почвах и их доступность растениям
- •Контрольные вопросы
- •2. Почвенные растворы
- •2.1. Концентрации и активности ионов и солей в почвенных растворах
- •2.2. Методы определения активности ионов
- •Контрольные вопросы
- •3. Катионообменная способность почв
- •3.1. Селективность катионного обмена
- •3.2. Кинетика обмена катионов
- •3.3. Уравнения и изотермы катионного обмена
- •3.4. Катионный обмен и адсорбция
- •3.5. Обменные катионы в почвах
- •Контрольные вопросы
- •4. Окислительно-восстановительные реакции и процессы в почвах
- •4.1. Окислительно-восстановительный потенциал почвы
- •4.2. Потенциалопределяющие системы в почвах
- •4.3. Окислительное состояние основных типов почв
- •4.4. Типы окислительно-восстановительных режимов
- •4.5. Влияние окислительно-восстановительных процессов на химическое состояние почв
- •4.6. Методы определения окислительных потенциалов и изучения окислительно-восстановительных режимов
- •Контрольные вопросы
- •Раздел II. Физика почв
- •1. Подготовка почвы к определению показателей физических свойств
- •1.1. Заложение и описание почвенного разреза
- •1.2. Морфологическое описание почвенного разреза
- •Пример морфологического описания почвы Разрез № 217
- •Контрольные вопросы
- •2. Определение гранулометрического состава почвы
- •Классификация почв и пород по гранулометрическому составу
- •2.1. Методы определения гранулометрического состава
- •2.1.1 Определение гранулометрического состава визуально и на ощупь
- •Визуальные методы определения гранулометрического
- •2.1.2 Лабораторные методы определения гранулометрического состава
- •Подготовка почвы к гранулометрическому анализу
- •Форма записи при определении гигроскопической влажности почвы
- •Определение гранулометрического состава в стоячей воде. Метод пипетки
- •Плотность и вязкость воды в зависимости от температуры
- •Интервалы во времени при взятии проб суспензии в зависимости от температуры суспензии и плотности частиц
- •Расчёт результатов анализа
- •Пример вычисления:
- •Пример записи данных гранулометрического анализа
- •Контрольные вопросы
- •3. Методы изучения структуры почвы
- •3.1. Морфологическое изучение почвенной структуры
- •3.2. Лабораторные методы изучения структуры почвы
- •3.2.1. Агрегатный анализ почвы (метод сухого рассева)
- •Форма записи результатов агрегатного анализа
- •3.2.2. Определение водопрочности структурных агрегатов по п.И. Андрианову
- •3.2.3. Микроагрегатный анализ
- •Форма записи результатов микроагрегатного анализа
- •3.2.4. Определение порозности агрегатов
- •Форма записи при определении порозности агрегата
- •Контрольные вопросы
- •4. Методы определения показателей общих физических свойств почвы
- •4.1. Определение плотности твёрдой фазы почвы
- •Состав и плотность некоторых минералов
- •Форма записи определения твёрдой фазы почвы
- •4.2. Определение плотности почвы
- •Форма записи определения плотности почвы
- •4.3. Определение пористости (порозности, скважности) почвы
- •4.4 Определение дифференциальной порозности методом расчёта
- •Форма записи определения дифференциальной порозности
- •4.5 Оценка показателей общих физических свойств почвы
- •Характеристика уплотненности почвы по величине плотности сложения (dV, г/см3) и порозности (p, % от объёма почвы)
- •Контрольные вопросы
- •5. Методы изучения водных свойств почвы
- •5.1 Определение влажности почвы
- •5.2 Определение водопроницаемости почвы
- •Оценка водопроницаемости почв тяжёлого гранулометрического состава
- •Форма записи результатов определения водопроницаемости почвы
- •5.3 Определение гидрологических характеристик почвы
- •Максимальная гигроскопичность почв, различных по гранулометрическому составу и средней гумусированности
- •5.4 Определение влагоёмкости почвы
- •Форма записи результатов определения капиллярной влагоёмкости
- •Оценка предельной полевой (наименьшей) влагоёмкости
- •5.5 Расчёты запасов влаги при определении наиболее важных гидрологических характеристик почвы
- •Контрольные вопросы
- •Раздел III. Статистическая обработка данных при изучении свойств почв
- •1. Статистические показатели вариационных рядов
- •Пример расчёта статистических показателей
- •Результаты статистической обработки данных определения плотности лугово-чернозёмной почвы в слое 0 – 20 см
- •2. Оценка существенности разницы выборочных средних
- •Примеры расчётов
- •Влияние использования лугово-чернозёмной почвы на водопрочность структуры
- •3. Корреляция и регрессия
- •Пример расчёта
- •Влажность устойчивого завядания растений при различной плотности пахотного слоя чернозёма обыкновенного
- •Расчет корреляционной зависимости между влажностью устойчивого
- •Слоя чернозёма обыкновенного
- •Заключение
- •Библиографический список
3.3. Уравнения и изотермы катионного обмена
Количественной характеристикой обмена катионов служат изотермы катионного обмена и соответствующие им уравнения изотерм катионного обмена. Изотермой катионного обмена называют графическое изображение зависимости между составом обменных катионов в ППК и составом катионов равновесного раствора. Изотермы обмена обычно строят в следующих координатах: по оси ординат откладывают отношения количеств обменных катионов в почвенном поглощающем комплексе, а по оси абсцисс – отношения концентраций или
активностей тех же ионов в равновесном растворе (рис. 1).
У равнение,
описывающее эту зависимость, называют
уравнением
изотермы катионного обмена:
равнение,
описывающее эту зависимость, называют
уравнением
изотермы катионного обмена:
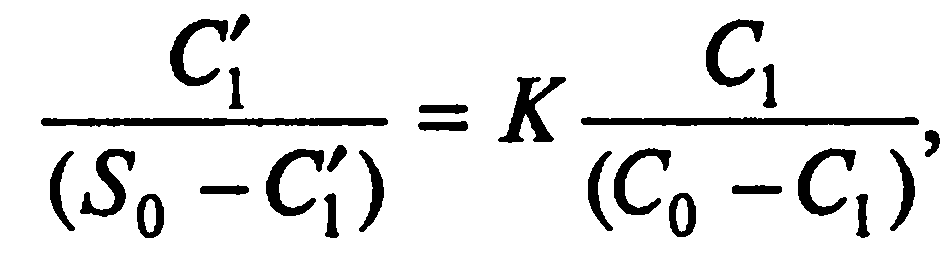
где С1' – число мг-экв/100 г почвы катиона в обменной форме на; С1 – его концентрации в равновесном растворе, мМ;
Рис. 1 Изотерма обмена количества
обменных катионов кальция и
магния
Со – общая концентрация катионов в растворе; So – емкость катионного обмена. Если в системе присутствуют катионы только двух видов/то Со – С1 отвечает концентрации катионов второго рода в растворе, а So – С1' – содержанию обменных катионов этого рода.
Аналогичную форму записи использовал X. Керр (1928), опираясь на закон действия масс и считая, что активные массы компонентов в твердых фазах пропорциональны их общей массе в составе почвы. В простейшем случае реакция обмена равновалентных катионов записывается, по Керру, так:
CaCl2(aq) + MgX2(s) = MgCl2(aq) + CaX2(s),
где индекс aq означает равновесный раствор; s – твердую фазу; X – соответствует одному эквиваленту почвенного поглощающего комплекса. Тогда константу реакции можно записать в виде:
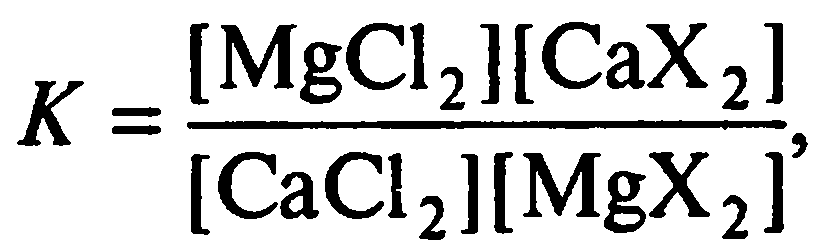
Уравнение изотермы для ее графического изображения привести к следующему виду:
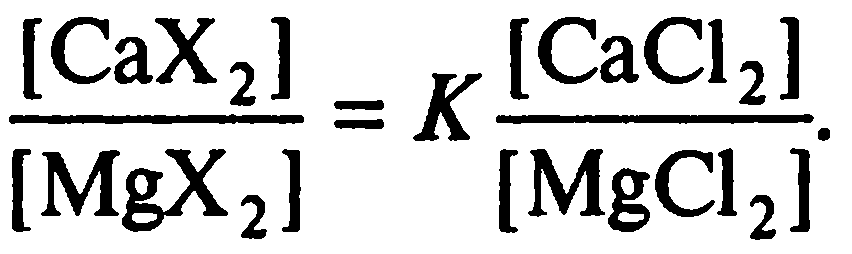
Прямолинейность изотермы, скорее, идеальный случай, чем правило; строгое подчинение катионного обмена уравнению Керра возможно при следующих условиях: равные заряды обменивающихся катионов, сравнительно небольшие изменения соотношения катионов в растворе, близкие значения коэффициентов активности, не слишком тяжелый гранулометрический состав почвы.
Для разновалентных катионов, особенно при высокой селективности поглощения и в широком диапазоне концентраций катионов раствора, изотермы часто приобретают сложную криволинейную форму, которую с некоторым приближением можно описать уравнением параболы. Наиболее полную форму уравнения предложил Б.П. Никольский:
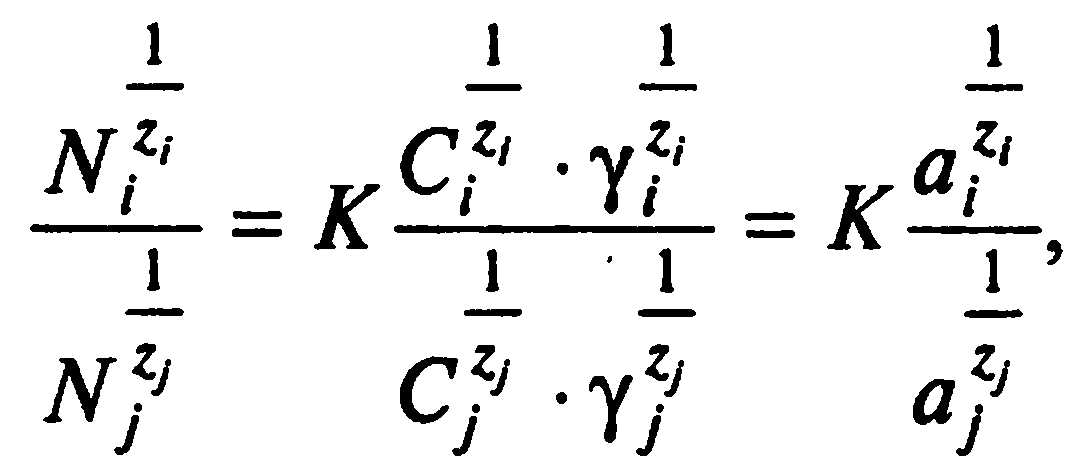
где Ni и Nj – количества обменных катионов i-го и j-го видов в ППК, мг-экв/г; zi и zj – их заряды; уi и yj – коэффициенты активности катионов в растворе; С – равновесная концентрация; ai и aj – активности тех же катионов в равновесном растворе.
Это уравнение отвечает закону действия масс, но концентрации и активности катионов берутся в степенях, обратных их зарядам, что
соответствует записи обменной реакции в форме:
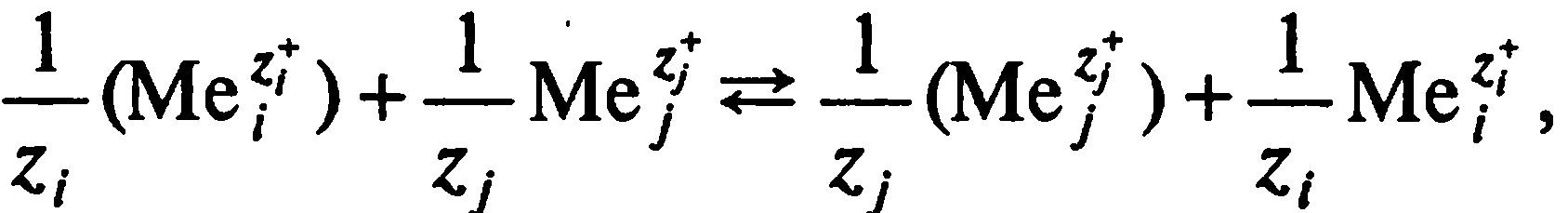
где Me – катион, а круглые скобки означают его нахождение в твердой фазе (использованы обозначения, принятые Б.П. Никольским).
Константа К в уравнении Б.П. Никольского есть не что иное, как коэффициент селективности. Среди других способов описания изотермы обмена представляет интерес уравнение Е.Н. Гапона, которое для обмена ионов Са2+ – Na+ можно записать, используя те же обозначения, что и в уравнении Б.П. Никольского, в следующем виде:
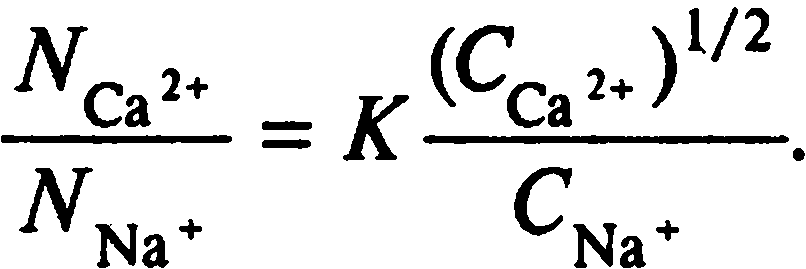
Уравнение Гапона основано на предположении, что обмен катионов осуществляется по реакции:
ПСа0,5 + Na+= ПNa + 0,5Са2+
Это уравнение основано на концентрациях, и в нем не принимаются во внимание заряды катионов в твердых фазах. Уравнение Е.Н. Гапона получило широкое распространение в мировой литературе благодаря относительно неплохому эмпирическому совпадению экспериментальных данных с результатами расчетов по этому уравнению. Сопоставление приведенных уравнений показывает, что их вид зависит от выбранного способа записи реакции обмена.
Уравнения катионного обмена, основанные на простой записи закона действия масс, требуют соблюдения ряда условий. В их число входят: постоянство рН, обратимость реакций обмена, равноценность всех адсорбционных центров ППК в отношении прочности связи с катионами одного рода и др. Несоблюдение этих предпосылок вызывает расхождение между теорией и экспериментом. Известно, что некоторые катионы, например К+, NH4+, после вхождения в ППК частично переходят в необменное состояние (фиксируются кристаллической решеткой слоистых силикатов); это нарушает эквивалентность обмена. Прочность связи катионов зависит от порядка их введения в ППК: ранее введенные в ППК катионы удерживаются почвой прочнее, чем последующие порции. Очевидна также и неравноценность адсорбционных центров. Достаточно одного из перечисленных факторов, чтобы вызвать расхождение между теоретической и экспериментальной изотермами катионного обмена.
Рассмотрим влияние неравноценности адсорбционных центров. Допустим, что ППК содержит два вида адсорбционных центров – А- и В- и они полностью связаны с катионами Mg2+, т.е. в ППК присутствуют соединения А2–Mg2+ и В2–Mg2+. Допустим также, что центр А- связывает катионы Са2+ более энергично, чем центр В-, т.е. прочность связи А2–Са2+ В2–Са2+. Введение в исходную систему ионов Са2+ приводит к тому, что в реакцию обмена вступают сначала центры первого рода:
![]()
После замещения магния в группах А2–Mg2+ происходит реакция:
![]()
Изотерма первой реакции при ее идеальном подчинении закону действия масс будет выражена прямой линией ОА (рис. 2).
П ри
большом числе адсорбционных центров
число изломов будет возрастать, и для
случая непрерывного изменения прочности
связи Са2+
с ППК как функции доли Са2+
в составе обменных катионов изотерма
обмена приобретает вид параболы. Если
изучается узкий интервал отношений
[Са2+]:
[Mg2+],
то соответствующий отрезок параболы
может мало отличаться от прямой линии.
ри
большом числе адсорбционных центров
число изломов будет возрастать, и для
случая непрерывного изменения прочности
связи Са2+
с ППК как функции доли Са2+
в составе обменных катионов изотерма
обмена приобретает вид параболы. Если
изучается узкий интервал отношений
[Са2+]:
[Mg2+],
то соответствующий отрезок параболы
может мало отличаться от прямой линии.
Рис. 2. Изотермы обмена ионов
кальция и магния:
1 – при двух видах активных центров
в почве; 2 – при большом числе
активных центров различного рода
Все это приводит к выводу о невозможности использования одних и тех же коэффициентов селективности для прогноза изменения состава обменных катионов при любых произвольно выбранных их отношениях.
