
- •Оглавление
- •Предисловие
- •Введение
- •Раздел I. Химия почв
- •1. Химический состав почв
- •1.1. Элементный состав почв
- •1.2. Фазовый состав почвы
- •1.3. Соединения щелочных и щелочно-земельных элементов в почвах
- •1.4. Формы соединений химических элементов в почвах и их доступность растениям
- •Контрольные вопросы
- •2. Почвенные растворы
- •2.1. Концентрации и активности ионов и солей в почвенных растворах
- •2.2. Методы определения активности ионов
- •Контрольные вопросы
- •3. Катионообменная способность почв
- •3.1. Селективность катионного обмена
- •3.2. Кинетика обмена катионов
- •3.3. Уравнения и изотермы катионного обмена
- •3.4. Катионный обмен и адсорбция
- •3.5. Обменные катионы в почвах
- •Контрольные вопросы
- •4. Окислительно-восстановительные реакции и процессы в почвах
- •4.1. Окислительно-восстановительный потенциал почвы
- •4.2. Потенциалопределяющие системы в почвах
- •4.3. Окислительное состояние основных типов почв
- •4.4. Типы окислительно-восстановительных режимов
- •4.5. Влияние окислительно-восстановительных процессов на химическое состояние почв
- •4.6. Методы определения окислительных потенциалов и изучения окислительно-восстановительных режимов
- •Контрольные вопросы
- •Раздел II. Физика почв
- •1. Подготовка почвы к определению показателей физических свойств
- •1.1. Заложение и описание почвенного разреза
- •1.2. Морфологическое описание почвенного разреза
- •Пример морфологического описания почвы Разрез № 217
- •Контрольные вопросы
- •2. Определение гранулометрического состава почвы
- •Классификация почв и пород по гранулометрическому составу
- •2.1. Методы определения гранулометрического состава
- •2.1.1 Определение гранулометрического состава визуально и на ощупь
- •Визуальные методы определения гранулометрического
- •2.1.2 Лабораторные методы определения гранулометрического состава
- •Подготовка почвы к гранулометрическому анализу
- •Форма записи при определении гигроскопической влажности почвы
- •Определение гранулометрического состава в стоячей воде. Метод пипетки
- •Плотность и вязкость воды в зависимости от температуры
- •Интервалы во времени при взятии проб суспензии в зависимости от температуры суспензии и плотности частиц
- •Расчёт результатов анализа
- •Пример вычисления:
- •Пример записи данных гранулометрического анализа
- •Контрольные вопросы
- •3. Методы изучения структуры почвы
- •3.1. Морфологическое изучение почвенной структуры
- •3.2. Лабораторные методы изучения структуры почвы
- •3.2.1. Агрегатный анализ почвы (метод сухого рассева)
- •Форма записи результатов агрегатного анализа
- •3.2.2. Определение водопрочности структурных агрегатов по п.И. Андрианову
- •3.2.3. Микроагрегатный анализ
- •Форма записи результатов микроагрегатного анализа
- •3.2.4. Определение порозности агрегатов
- •Форма записи при определении порозности агрегата
- •Контрольные вопросы
- •4. Методы определения показателей общих физических свойств почвы
- •4.1. Определение плотности твёрдой фазы почвы
- •Состав и плотность некоторых минералов
- •Форма записи определения твёрдой фазы почвы
- •4.2. Определение плотности почвы
- •Форма записи определения плотности почвы
- •4.3. Определение пористости (порозности, скважности) почвы
- •4.4 Определение дифференциальной порозности методом расчёта
- •Форма записи определения дифференциальной порозности
- •4.5 Оценка показателей общих физических свойств почвы
- •Характеристика уплотненности почвы по величине плотности сложения (dV, г/см3) и порозности (p, % от объёма почвы)
- •Контрольные вопросы
- •5. Методы изучения водных свойств почвы
- •5.1 Определение влажности почвы
- •5.2 Определение водопроницаемости почвы
- •Оценка водопроницаемости почв тяжёлого гранулометрического состава
- •Форма записи результатов определения водопроницаемости почвы
- •5.3 Определение гидрологических характеристик почвы
- •Максимальная гигроскопичность почв, различных по гранулометрическому составу и средней гумусированности
- •5.4 Определение влагоёмкости почвы
- •Форма записи результатов определения капиллярной влагоёмкости
- •Оценка предельной полевой (наименьшей) влагоёмкости
- •5.5 Расчёты запасов влаги при определении наиболее важных гидрологических характеристик почвы
- •Контрольные вопросы
- •Раздел III. Статистическая обработка данных при изучении свойств почв
- •1. Статистические показатели вариационных рядов
- •Пример расчёта статистических показателей
- •Результаты статистической обработки данных определения плотности лугово-чернозёмной почвы в слое 0 – 20 см
- •2. Оценка существенности разницы выборочных средних
- •Примеры расчётов
- •Влияние использования лугово-чернозёмной почвы на водопрочность структуры
- •3. Корреляция и регрессия
- •Пример расчёта
- •Влажность устойчивого завядания растений при различной плотности пахотного слоя чернозёма обыкновенного
- •Расчет корреляционной зависимости между влажностью устойчивого
- •Слоя чернозёма обыкновенного
- •Заключение
- •Библиографический список
3.1. Селективность катионного обмена
Количественное соотношение между двумя любыми обменными катионами в ППК не равно отношению активностей (или концентраций) тех же катионов в равновесном растворе. Это означает, что при равной активности катионов раствора один из них поглощается почвой в больших количествах и удерживается более прочно. Иными словами, почвы обладают способностью селективно (избирательно) поглощать катионы одного рода в ущерб катионам другого рода.
В общей форме коэффициент селективности можно записать так:
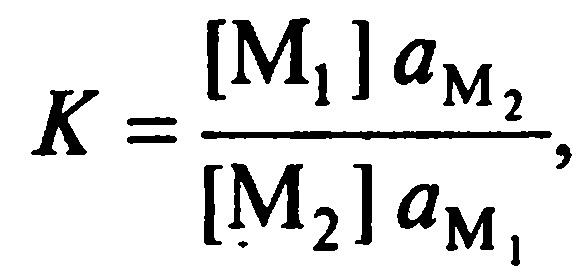
где M1 и М2 – катионы 1-го и 2-го рода.
Селективность зависит как от свойств катионов, так и от химических особенностей компонентов ППК. В общем случае предпочтительнее связываются катионы с более высоким зарядом, а при равных зарядах – катионы с большей атомной массой. Это правило иллюстрируется следующими рядами катионов, расположенных в порядке возрастания степени их поглощения почвой:
Li+ < Na+ < NH4+; < К+ < Rb+ < Cs+ < H+;
Mg2+ < Ca2+ < Ba2+;
Al3+ < Fe3+.
Исключение в ряду однозарядных катионов составляет только протон. Специфика почвенного поглощающего комплекса может изменить порядок расположения катионов в ряду поглощения, как это видно из следующих рядов поглощения на различных минералах (по П. Шахтшабелю):
монтмориллонит Li+< Na+< K+< H+< Rb+< Mg2+< Ca2+=Sr2+< Ba2+;
каолинит Li+< Na+< H+< K+< Rb+< Mg2+< Ca2+ = Si2+ = Ва2+;
мусковит Li+< Na+< Mg2+< Ca2+< Sr2+< Rb+< Cs+< K+< Ba2+.
Избирательность поглощения связана с характером адсорбционных центров и ионными радиусами катионов. Взаимодействие между отрицательными зарядами поверхности твердых частиц ППК и катионами можно рассматривать с чисто электростатических позиций; в этом случае следует ожидать, что в соответствии с законом Кулона сила взаимодействия будет нарастать при увеличении заряда катиона и уменьшении его радиуса. Это одна из причин преимущественного поглощения двух- и трехзарядных катионов. Но поскольку ионы в почвенном растворе гидратированы, часто преимущество получают катионы с меньшей гидратационной оболочкой.
Значительную роль в селективности обмена играют свойства анионной части ППК. В качестве адсорбционных центров ППК выступают участки сколов кристаллов, диссоциирующие гидроксильные группы; часть обменных катионов входит в межпакетные промежутки глинистых минералов. Предпочтительнее удерживаются этими центрами те катионы, для которых радиус (с учетом гидратной оболочки) соответствует кристаллохимическим особенностям структур активных центров.
Активными центрами органической части ППК служат преимущественно кислые функциональные группы – карбоксильные и фенольные. Селективность поглощения катионов в этом случае обусловлена различной прочностью их связи с функциональными группами и зависит от расположения последних в молекуле. Если феноль-
ная и гидроксильная группы находятся в ортоположении, то они образуют прочные соединения с двух- и трехвалентными катионами; селективность поглощения последних по сравнению с одновалентными катионами нарастает. Тот же эффект проявляется при взаимодействии катионов с двумя рядом расположенными группами СООН
независимо от того, принадлежат они циклическим или алифатическим структурам. Избирательность к ионам Fe3+ и А13+, обусловленная пространственным расположением функциональных групп.
Селективность поглощения катионов нарастает с увеличением констант диссоциации кислых функциональных групп; константы диссоциации повышаются, если соседний с функциональной группой атом углерода несет электроотрицательный заместитель. Нарастание окисленности органического вещества ППК и констант диссоциации приводит к тому, что предпочтительнее поглощаются поливалентные катионы, а щелочные и щелочно-земельные катионы уступают место переходным металлам. Для ряда почв было показано, что увеличение рН от 4 до 7 вызывало резкое увеличение поглощения Mg2+, заметно увеличивало поглощение К+ и практически не влияло на поглощение Na+.
