
- •Вступ…………………………………………………………………………......5
- •Інструкція з техніки безпеки в лабораторії хімії
- •Тема 1.1.: «Основи хімічної термодинаміки»
- •2. Визначити тепловий ефект хімічної реакції методом розрахунку теплового ефекту.
- •Хід роботи
- •Результати калориметричних досліджень процесу нейтралізації хлоридної кислоти гідроксидом натрію
- •Контрольні питання та практичні завдання
- •Тема 1.1.: «Основи хімічної термодинаміки» Лабораторна робота № 2
- •«Визначення коефіцієнта розподілу йоду між бензолом та водою»
- •Теоретичне підгрунтя
- •Хід роботи
- •Контрольні питання та практичні завдання
- •Тема 1.3.: «Електрохімія» Лабораторна робота № 3
- •«Інгібіторний захист від корозії»
- •Теоретичне підгрунтя
- •Нанесення металевих покриттів
- •Нанесення неметалевих покриттів
- •Електрохімічні методи захисту
- •Хімічні методи захисту
- •Хід роботи
- •Контрольні питання та практичні завдання
- •Тема 2.3.: «Поверхневі явища і адсорбція»
- •Контрольні питання та практичні завдання
- •Тема 2.4.: «Електрокінетичні властивості, стабілізація і коагуляція золей» Лабораторна робота № 5
- •«Методи приготування золів»
- •Хід роботи
- •Приготування золів методом заміни розчинника (зниження розчинності)
- •Приготування золю каніфолі.
- •Приготування золю сірки.
- •Приготування золів методом хімічної конденсації (як наслідок хімічної реакції)
- •Гідроліз хлориду феруму (ііі) FeCl3
- •Приготування золю берлінської блакиті (реакція подвійного обміну).
- •Приготування золю оксиду мангана(іу).
- •1. Метод пептизації.
- •Контрольні питання та практичні завдання
- •Тема 2.4.: «Електрокінетичні властивості, стабілізація і коагуляція золів» Лабораторна робота № 6
- •«Визначення порога коагуляції»
- •Теоретичне підгрунтя
- •Хід роботи
- •Отримання гідрозолю гідроксиду заліза.
- •Визначення порога коагуляції.
- •Порядок подання результатів.
- •Об’єми розчинів, що додаються, мл
- •Контрольні питання та практичні завдання
- •Тема 2.7: «Розчинення високомолекулярних сполук»
- •Хід роботи Дослід 1. Визначення ступеня набухання гуми і желатину
- •Дослід 2. Вивчення кінетики набухання зерна
- •Контрольні питання та практичні завдання
- •Література
Хід роботи
Дослід 1: Визначення калориметричної сталої. Дослідження процесу нейтралізації проводять в установці, зображеній на рис. 1. Сталу калориметричної установки (К), зображеної на рис. 1, можна визначити за відомою теплотою розчинення якої-небудь солі чи лугу, наприклад, за відомою теплотою розчинення натрію гідроксиду – 112,1 кДж/моль. В склянку 1 наливають 500 см3 дистильованої води, включають магнітну мішалку і спостерігають за температурою, значення якої можуть коливатись за рахунок теплообміну з навколишнім середовищем. Відмічають температуру з точністю 0,10 С кожних півхвилини. З точністю 0,01 г на технічних вагах зважують 5 г попередньо висушеного гранульованого гідроксиду натрію. Після стабілізації температури системи, через отвір 5 вносять наважку твердого натрій гідроксиду, продовжуючи відмічати зміну температури з часом. В результаті розчинення натрій гідроксиду температура системи зростатиме (екзотермічний тепловий ефект процесу), а стабілізація температури у часі на деякій позначці свідчитиме про завершення процесу розчинення. Зміну температури у процесі розчинення натрій гідроксиду ілюструє рис. 2.
|
|
Рис. 1. Схема калориметричної установки: 1 – хімічна склянка з теплоізоляцією; 2 – магнітна мішалка; 3 – термометр; 4 – кришка; 5 – отвір для внесення твердих речовин; 6 – дистильована вода |
Рис. 2. Схематичне зображення часової залежності температури системи у ході екзотермічного процесу |
На
міліметровому папері будують
експериментально одержану залежність
температура – час: Т=f(t),
і визначають величину скачка температури
Т графічним
способом, як показано на рис. 1, 2.
Визначивши Т,
обчислюють калориметричну сталу за
рівнянням:
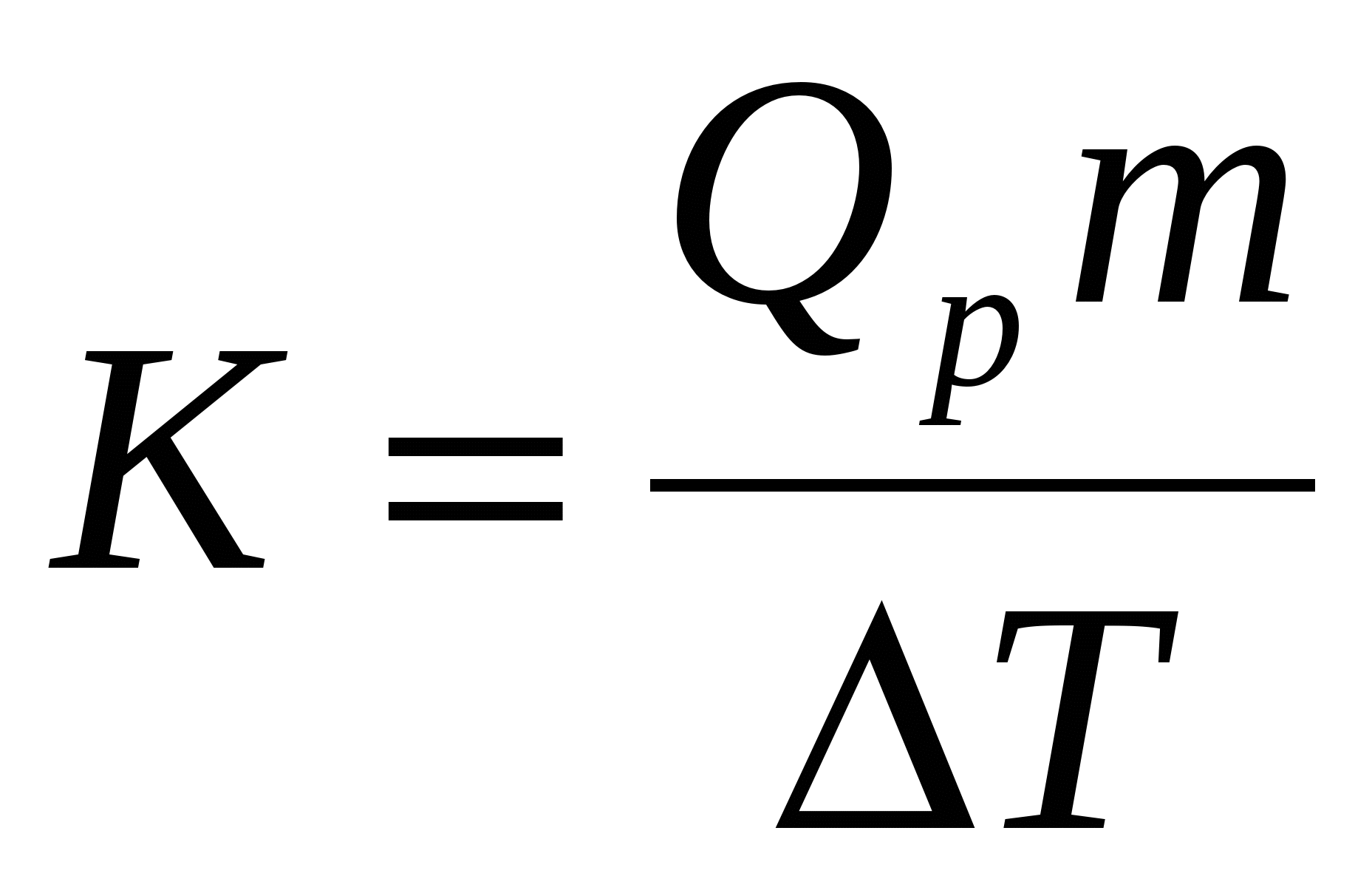 ,
де Qp –
теплота розчинення гідроксиду натрію
(112,1 кДж/моль);
,
де Qp –
теплота розчинення гідроксиду натрію
(112,1 кДж/моль);
m – кількість молів лугу.
Дослід 2: Визначення теплового ефекту нейтралізації. В склянку наливають 500 см3 0,5 н розчину хлоридної кислоти і витримують при кімнатній температурі деякий час. Як і в досліді 1 включають мішалку і спостерігають за температурою, відмічаючи її кожні півхвилини. Після стабілізації температури вносять наважку 5 г гранульованого натрій гідроксиду (попередньо висушеного), продовжуючи відмічати значення температури з часом до моменту її стабілізації. Графічним способом (рис. 2, дослід 1) визначають скачок температури у ході процесу. Спостережуваний тепловий ефект процесу (∆ Q) є сумою ефектів розчинення (Qp) та нейтралізації (Qн): ∆Q = Qp + Qн.
Враховуючи
цей момент, тепловий ефект нейтралізації
обчислюють, виходячи із наступної
формули: ,
де
К –
калориметрична стала; m –
кількість натрій гідроксиду, взятого
для нейтралізації; Т –
сумарний скачок температури за рахунок
екзотермічного розчинення та екзотермічного
теплового ефекту нейтралізації.
Результати досліджень вносять у таблицю
1.
Таблиця 1
,
де
К –
калориметрична стала; m –
кількість натрій гідроксиду, взятого
для нейтралізації; Т –
сумарний скачок температури за рахунок
екзотермічного розчинення та екзотермічного
теплового ефекту нейтралізації.
Результати досліджень вносять у таблицю
1.
Таблиця 1


