
- •Тема 2.1.
- •Класифікація, отримання та очищення
- •Дисперсних систем
- •Основні признаки дисперсних систем
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи диспергування
- •4 . Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Т2.1. «класифікація, отримання та очищення дисперсних систем»
- •Тема 2.2.
- •1.Теорія броунівського руху
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Самостійна робота
- •«Поверхневі явища і адсорбція»
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Електричні властивості колоїдних систем
- •1.Запишіть рівняння реакції, що приводить до утворення золю.
- •2. Встановити склад ядра колоїдної частинки.
- •3. Встановити, яка з речовин знаходиться в надлишку.
- •8. Продовжити схему будови міцели, записавши шар противоіонів.
- •9. Зафіксувати знак заряду записаної вами системи - колоїдної частинки:
- •Самостійна робота
- •Т 2.4. «електрокінетичні властивості, стабілізація і коагуляція золів»
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Загальні відомості
- •2. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •3. Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •4. Піни, їх будова і стійкість
- •Будова пін та їх визначення
- •Одержання пін
- •Характеристика піноутворювачів та їх значення
- •Застосування пін
- •Можливі джерела утворення, тип і форма деяких пін у харчовій промисловості і продуктах харчування
- •Аерозолі та їх властивості
- •Розміри частинок димів і туманів
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •Визначення порошків та їх розміри
- •Методи одержання порошків
- •Особливості порошків
- •Аерозолі та їх використання
- •Правда і вигадка про аерозолі
- •По темі 2.6. «Мікрогетерогенні та грубодисперсні системи»
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •4. Драглі, їх утворення
- •Характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Самостійна робота
- •Термінологічний словник
- •Література
Будова міцели гідрозоля
Колоїдна міцела – структура досить складна. Вона не має певного хімічного складу і маси. Однак принципові питання щодо будови міцели останнім часом з’ясовані чітко й однозначно.
Будь-яка колоїдна система складається з дисперсної фази і дисперсійного середовища. В гідрозолях дисперсним середовищем є вода, а дисперсною фазою - тверді частинки колоїдної дисперсності, що називаються міцелами.
Основну частину міцели займає агрегат, що складається з великої кількості атомів, іонів або молекул нерозчинної у воді речовини і має кристалічну або аморфну будову.
На поверхні твердого кристалічного агрегату фіксуються іони стабілізатора, які визначають знак і величину поверхневого потенціалу (потенціал визначаючі іони). Ця частина міцели, тобто агрегат сумісно з потенціал визначаючими іонами, називається ядром.
Н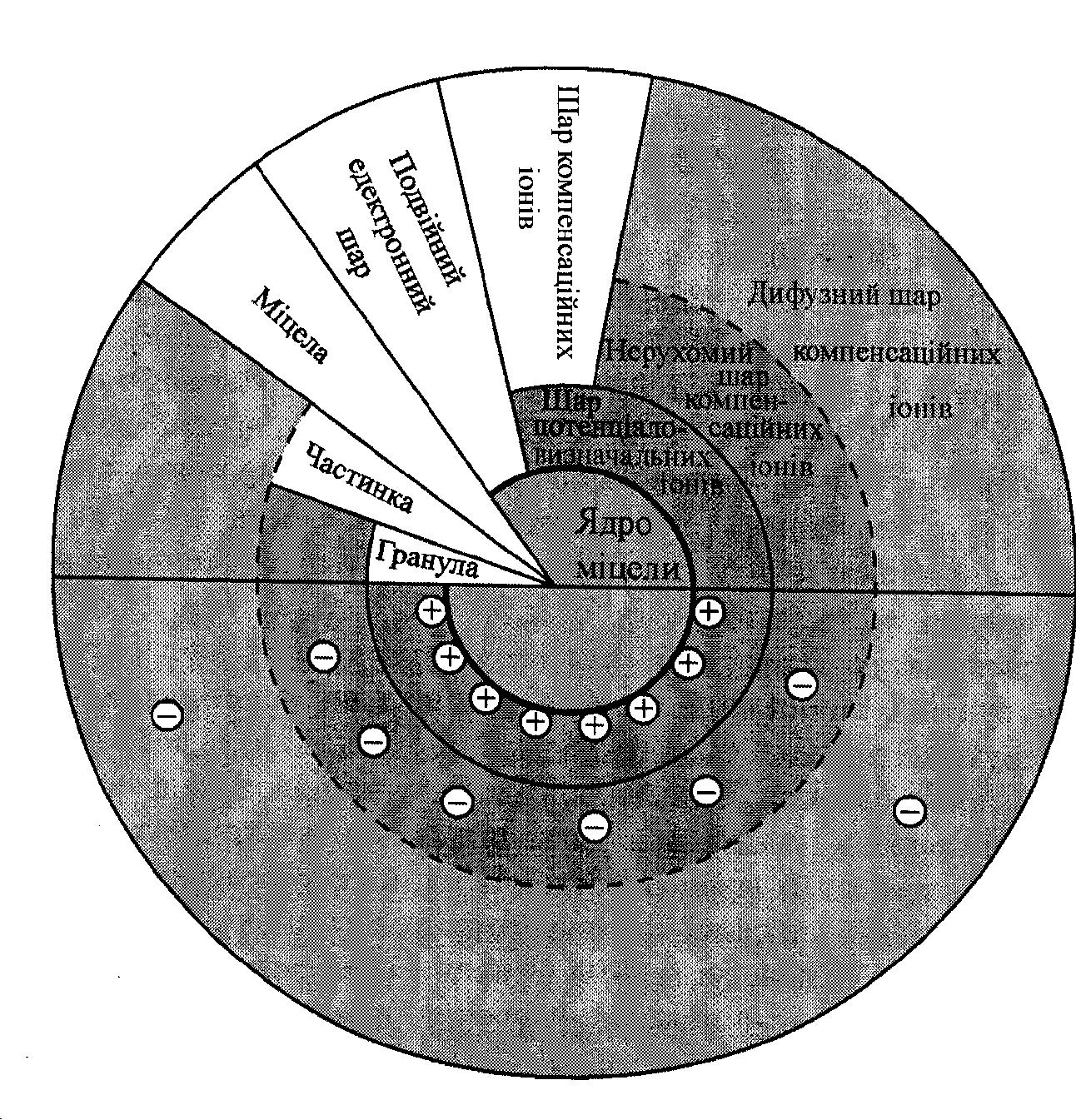 авкруги
ядра розташовується частина противоіонів
стабілізатора, що утворює адсорбційний
шар.
авкруги
ядра розташовується частина противоіонів
стабілізатора, що утворює адсорбційний
шар.
Рис.24. Будова міцели колоїдного розчину.
Ядро разом з адсорбційним шаром противоіонів складає колоїдну частинку або гранулу. Вона завжди має заряд, що відповідає знаку заряду потенціал визначаючих іонів.
Інші противоіони утворюють дифузний шар міцели. Таким чином, міцела – електро-нейтральна структура. При пропусканні постійного електричного струму через колоїдний розчин до електродів рухаються не міцели, які в цілому нейтральні, а тільки гранули.
Розглянемо докладніше будову колоїдних частинок на прикладі колоїдного розчину йодиду срібла, який утворюється за реакцією:
Kl + AgNO3 = ↓Agl + KNO3
Стійкий золь іодида срібла може бути одержаний тільки при дотримуванні двох умов:
розчини реагентів повинні бути розбавленими
одна з реагуючих речовин береться в надлишку (правило Фаянса-Панета).
М
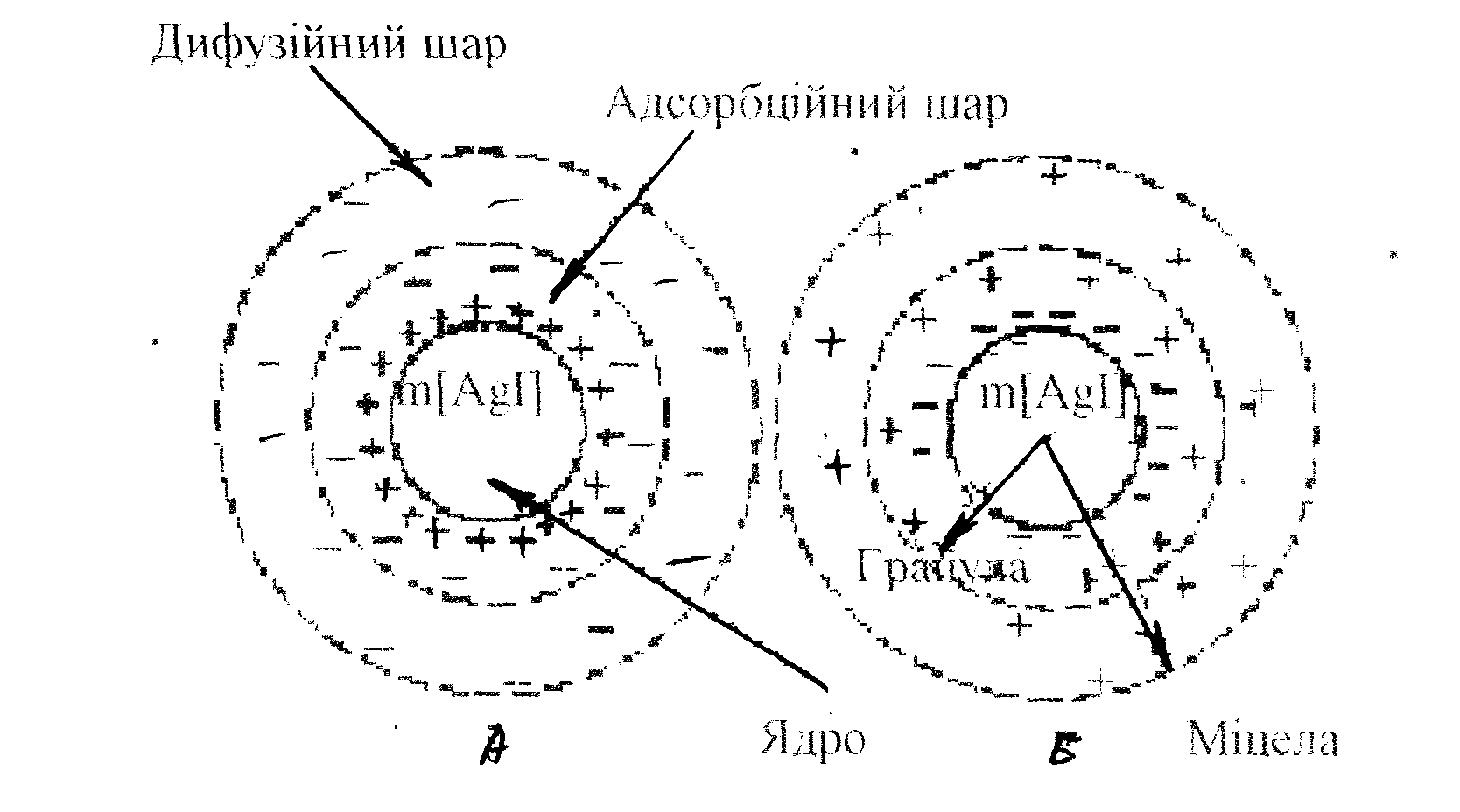 олекули
нерозчинного йодиду срібла утворюють
ядро колоїдної частинки. Ядро в даному
прикладі - дрібний кристалик йодиду
срібла, на поверхні якого адсорбуються
іони аргентуму, чи іони йоду, бо
адсорбуються зазвичай іони, що входять
до складу ядра частинки.
олекули
нерозчинного йодиду срібла утворюють
ядро колоїдної частинки. Ядро в даному
прикладі - дрібний кристалик йодиду
срібла, на поверхні якого адсорбуються
іони аргентуму, чи іони йоду, бо
адсорбуються зазвичай іони, що входять
до складу ядра частинки.
Рис.25. Будова міцел золя йодистого срібла.
а) при надлишку АgNО3, б) при надлишку КІ.
Ці іони, що адсорбуються на поверхні ядра, називаються потенціал визначаючими іонами. При надлишку АgNОз адсорбуються іони Аg+, при надлишку в реакції КІ - іони І-. В першому випадку ядро одержує позитивний заряд), а в другому – від’ємний заряд.
Іони, протилежні по знаку потенціал визначаючим іонам, - противоіони частково тісно примикають до адсорбованих, частково розташовуються дифузно, тобто рухомі і розсіяні. При цьому в адсорбційному шарі переважають потенціал визначаючі іони, а в дифузному - противоіони.
Будову міцели зручно представляти у вигляді формули. Для золя AgI формула міцели пишеться так:
{m [AgI] ∙ nAg+ ∙ (n – x) NO3-} xNO3

Агрегат

 Ядро
Ядро

 Частинка
Частинка

 Міцела
Міцела
m – число молекул AgI, що входять до складу агрегата;
n – число потенціал визначаючих іонів Ag+ m >>n.
Загальне число противоіонів NO3 також дорівнює n, але частина з них (n-x) входить в адсорбційний шар і знаходиться поблизу ядра, а друга частина противоіонів Х складає дифузійний шар.
Якщо стабілізатором цього золя буде не AgNO3, а КІ, то формула міцели запишеться так:
{m [AgI] ∙ nІ- ∙ (n – x) К+} xК+
Для гідрозоля гідроксиду заліза, одержаного гідролізом FeCL3, формула міцели має вигляд:
{m [Fe (OH)3] ∙ nFe3+ ∙ 3 (n – x)CL-} xCL-
В цілому міцела електронейтральна і коефіцієнт 3 враховує заряд іонів заліза.
Прикладом золя, в якому стабілізатор утворюється при взаємодії речовини дисперсної фази з дисперсійним середовищем, може бути гідрозоль діоксиду (кремнію) сіліціума. На поверхні агрегату можлива реакція з утворенням метакремнієвої кислоти:
SiO2 + H2O = H2SiO3,
яка служить стабілізатором цього золя. Будову міцели гідрозоля діоксиду сіліціуму можна зобразити слідуючою формулою:
{m [SiO2] ∙ nHSiO3 ∙ (n – x) H+} xH+
При електрофорезі під дією електричного поля до одного з електродів рухаються колоїдні частинки, до другого – іони дифузного шару. Тобто дифузний шар рухомий і здатний переміщуватись відносно твердої частинки з адсорбційним шаром. Товщина дифузного шару змінюється в залежності від змін концентрації і зарядів іонів, що мають протилежний знак по відношенню до ядра. Протиіони цих двох шарів знаходяться в стані рухомої рівноваги.
Елементарна колоїдна частинка – міцела, попавши в електричне поле, руйнується. Із міцели утворюється заряджена частинка, яка починає рухатись до протилежно зарядженого електрода, а іони з дифузного шару, що відірвались від міцели, рухаються в протилежному напрямі. Так відбувається електрофорез. Швидкість електрофорезу визначається зарядом частинки, тобто електрокінетичним потенціалом. Цілком аналогічне явище відбувається і при електроосмосі.
