
- •Тема 2.1.
- •Класифікація, отримання та очищення
- •Дисперсних систем
- •Основні признаки дисперсних систем
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи диспергування
- •4 . Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Т2.1. «класифікація, отримання та очищення дисперсних систем»
- •Тема 2.2.
- •1.Теорія броунівського руху
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Самостійна робота
- •«Поверхневі явища і адсорбція»
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Електричні властивості колоїдних систем
- •1.Запишіть рівняння реакції, що приводить до утворення золю.
- •2. Встановити склад ядра колоїдної частинки.
- •3. Встановити, яка з речовин знаходиться в надлишку.
- •8. Продовжити схему будови міцели, записавши шар противоіонів.
- •9. Зафіксувати знак заряду записаної вами системи - колоїдної частинки:
- •Самостійна робота
- •Т 2.4. «електрокінетичні властивості, стабілізація і коагуляція золів»
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Загальні відомості
- •2. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •3. Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •4. Піни, їх будова і стійкість
- •Будова пін та їх визначення
- •Одержання пін
- •Характеристика піноутворювачів та їх значення
- •Застосування пін
- •Можливі джерела утворення, тип і форма деяких пін у харчовій промисловості і продуктах харчування
- •Аерозолі та їх властивості
- •Розміри частинок димів і туманів
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •Визначення порошків та їх розміри
- •Методи одержання порошків
- •Особливості порошків
- •Аерозолі та їх використання
- •Правда і вигадка про аерозолі
- •По темі 2.6. «Мікрогетерогенні та грубодисперсні системи»
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •4. Драглі, їх утворення
- •Характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Самостійна робота
- •Термінологічний словник
- •Література
Тема: 2.3. Поверхневі явища і адсорбція план
1. Адсорбція, її види.
2. Адсорбція на межі розчин-газ.
3. Адсорбція на межі тверде тіло-газ.
4. Капілярна конденсація.
5. Молекулярна адсорбція з розчинів.
6. Іонообмінна адсорбція.
7. Адсорбція з багатокомпонентних розчинів.
8. Принцип хроматографічного аналізу.
ВИВЧИВШИ ТЕМУ, ВИ ПОВИННІ:
Знати:
вільну поверхневу енергію; поверхневу активність;
види сорбції;
адсорбцію на межі “тверде тіло-газ”, “тверде тіло-розчин”, “рідина-газ”, “рідина-рідина”, основні закономірності, вплив різних факторів на адсорбцію;
основні положення теорії Ленгмюра;
рівняння Ленгмюра.
рівняння Гіббса, правило Траубе;
особливості поведінки ПАР та їх використання;
характеристику іоннообмінної адсорбції;
особливості хроматографії.
Вміти:
визначити динаміку адсорбції та записувати закон адсорбції для конкретних умов;
аналізувати рівняння Гіббса, Ленгмюра.
Адсорбція , її види
Чимало хімічних і фізико-хімічних процесів здійснюються на межі поділу двох фаз: тверде тіло-газ (пара), тверде тіло-рідина, рідина-газ. Перебіг таких процесів суттєво залежить від стану і властивостей поверхні поділу фаз, що стикаються.
Молекула, яка знаходиться всередині рідини чи твердого тіла, з усіх боків оточена подібними молекулами, і рівнодійна всіх сил, що діють на неї, дорівнює нулю (рис.10).
Р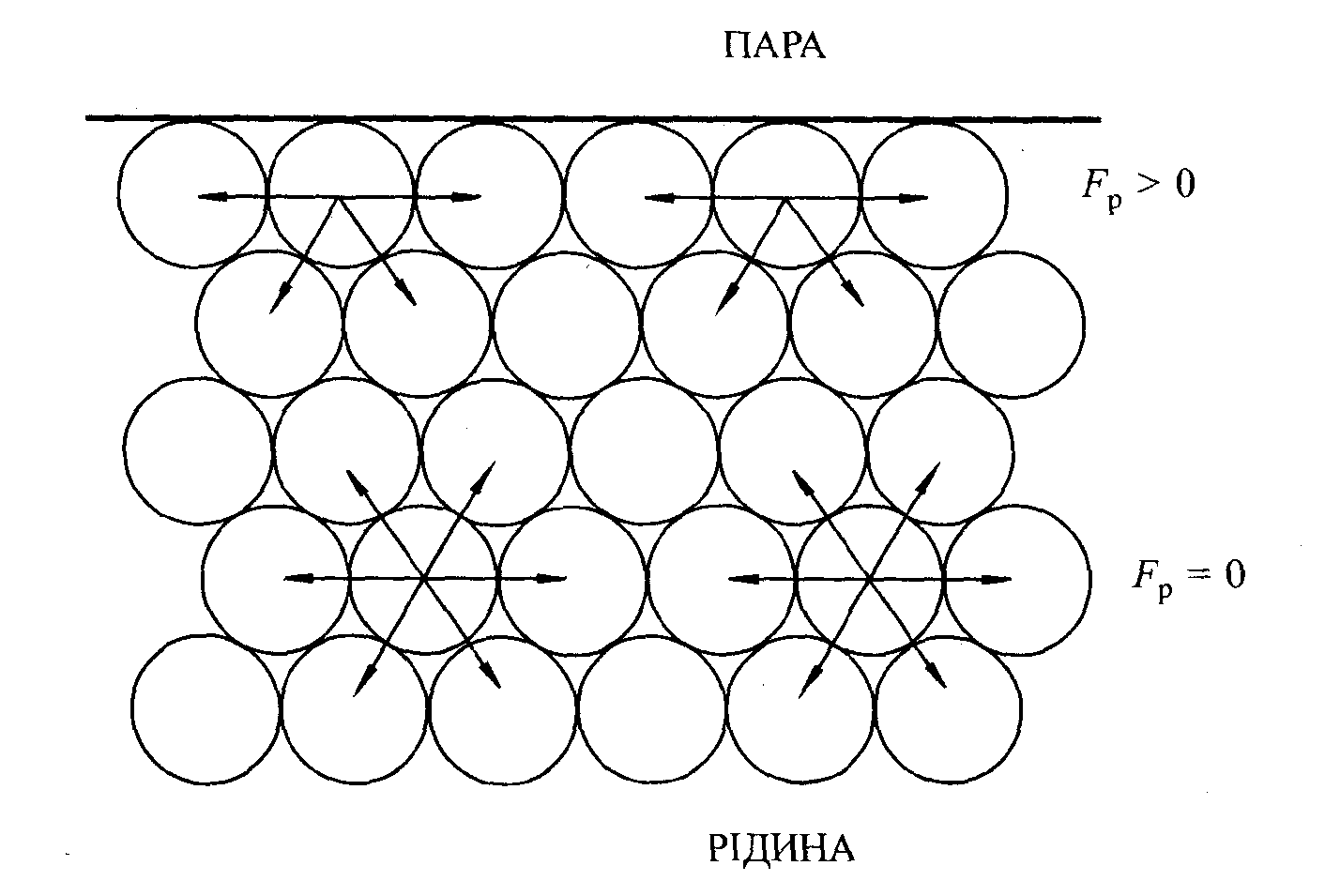 ис.
10. Сили, що впливають на молекулу
всередині рідини та на поверхні.
ис.
10. Сили, що впливають на молекулу
всередині рідини та на поверхні.
Зовсім в іншому стані є молекули на поверхні. Сили їх взаємодії з молекулами, які знаходяться внизу, залишаються такими ж, як і в середині рідини. Таким чином, у поверхневих молекулах їх здатність до взаємодії з іншими молекулами реалізується неповністю і тому вони мають нескомпенсований надлишок енергії, який називають вільною поверхневою енергією.
Поверхнева енергія тіл суттєво зменшується при накопиченні на цій поверхні деяких інших молекул, атомів чи іонів з газової чи рідкої фази.
Сорбція – поглинання будь-якою речовиною інших речовин.
Сорбція широко пошерена в природі і техніці. Багато пористих і тонкодисперсних тіл поглинають великі об’єми газів і парів, що у сотні разів перевищують об’єм поглинача. Залежно від характеру взаємодії між поглиначем (сорбентом) і речовиною, що поглинається (сорбтивом), розрізняють декілька типів сорбції.
Адсорбція - збільшення концентрації речовини на межі розділу фаз. Адсорбція - це самочинний неврівноважений процес перерозподілу компонентів системи або суміші між поверхневим шаром та об'ємною фазою.
Адсорбент – це речовина, що здатна поглинати (адсорбувати) інші речовини на своїй поверхні.
Адсорбтив – це речовина, молекули якої здатні поглинатися адсорбентом.
Адсорбат – це речовина, що вже адсорбована.
Адсорбцію не слід плутати з поняттям «абсорбція».
Абсорбція –процес сорбції, при якому речовина, що поглинається, дифундує всередину речовини, що її поглинає і розподіляється по її об’єму.
Прикладом абсорбції є поглинання світлової енергії розчинами або поглинання водню платиною і паладієм. Абсорбцією є також поглинання парів води сірчаної кислоти.
Для визначення адсорбції необхідно знайти експериментально тиск газу або кількість адсорбтиву в об'ємі, у якому відбувається адсорбція, до й після адсорбції. Найчастіше адсорбцію визначають за приростом ваги адсорбенту.
Загальну термодинамічну теорію адсорбції розробив наприкінці XIX століття Гіббс. В XX столітті адсорбцію досліджували: Ленгмюр, Поляні, Брунауер, Гурович, Шилов, Дубінін і ін.
Розрізняють фізичну, або ван-дер-ваальсову, адсорбцію та хімічну, або хемосорбцію. Перша обернена, а друга - не обернена.
Хемосорбція – це поглинання, що супроводжується хімічною реакцією.
Наприклад, до хемосорбції належить явище поглинання карбон (ІV) оксиду кальцій гідроксидом (гашеним вапном). При цьому відбувається хімічна реакція:
Са(ОН)2 + СО2 = СаСО3 + Н2О
При хімічній адсорбції молекули втрачають рухливість, бо молекули адсорбата зв’язані з поверхнею твердого тіла звичайними ковалентними силами хімічного зв’язку. Ці сили в багато разів перевищують сили Ван-дер-Ваальса. У випадку фізичної адсорбції можуть мати місце локалізована та нелокалізована адсорбції. Для останньої характерне те, що молекули адсорбтиву здатні зміщуватися по поверхні, переборюючи певні потенційні бар'єри, що утворилися між місцями локалізації цих молекул. У локалізованій абсорбції молекули адсорбтиву не здатні зміщуватися по поверхні. Вони утворюють більш міцні вандерваальсові, або водневі зв'зки з певними атомами чи молекулами поверхні. Таким чином, сили, що утримують адсорбат на поверхні твердого адсорбента, мають різну природу.
Внаслідок теплового руху поряд з адсорбцією відбувається також обернений процес — десорбція.
Десорбція – це процес зворотній адсорбції.
Слід, однак, зазначити, що наведена класифікація досить умовна. Практично немає ні чисто фізичної, ні чисто хімічної адсорбції. У кожному конкретному випадку можна говорити лише про домінуючу роль того чи іншого виду адсорбції, коли іншими видами практично можна знехтувати.
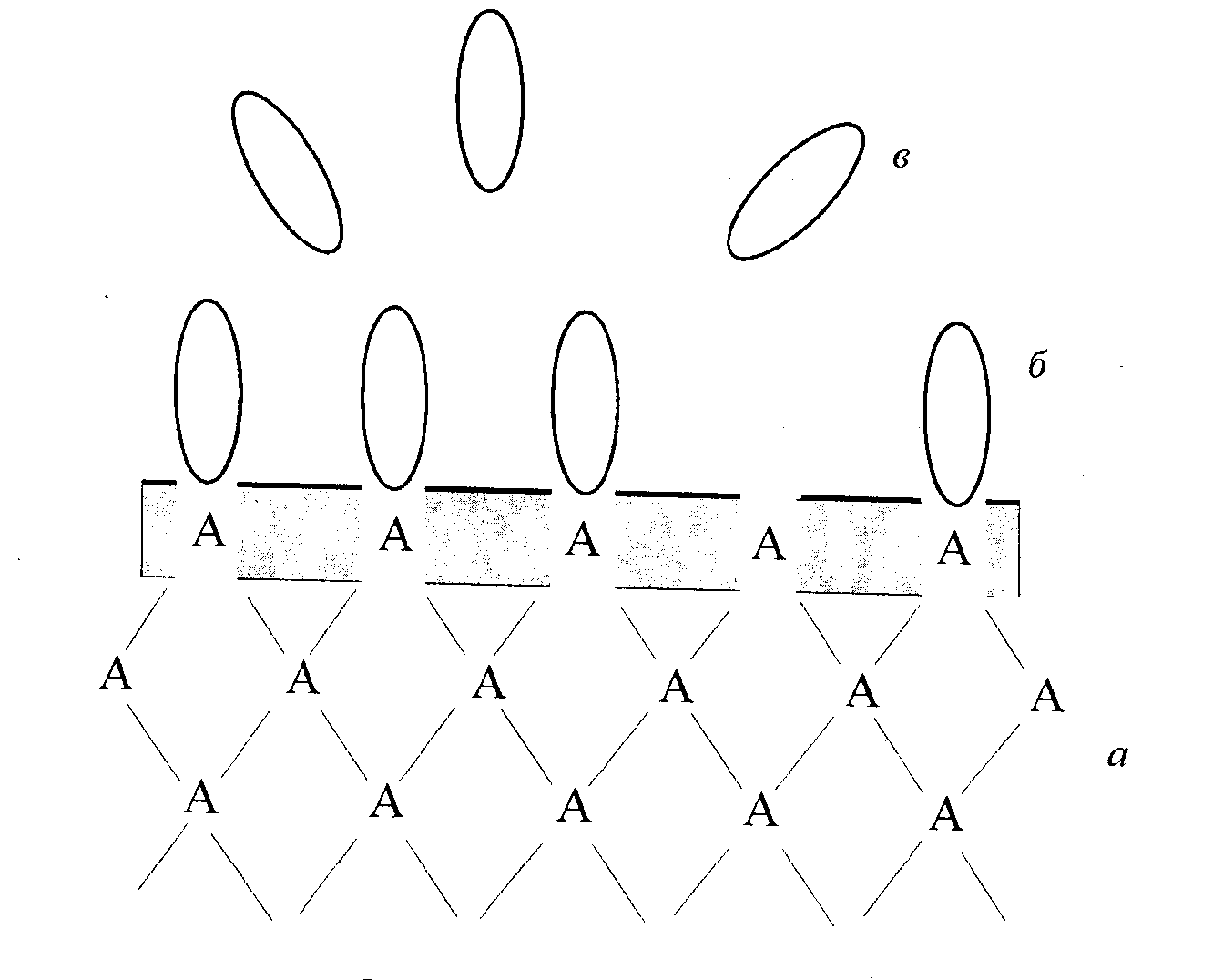
Рис.11. Схема процесу адсорбції
( а – адсорбент, б – адсорбат, в – адсорбтив)
Для кожної концентрації адсорбтиву в навколишньому середовищі існує свій стан адсорбційної рівноваги, а кількість адсорбованої речовини у випадку фізичної адсорбції зменшується з підвищенням температури.
Кількісною характеристикою адсорбції служить величина адсорбції.
Величина адсорбції Г виражається кількістю х адсорбованої речовини, що приходиться на одиницю площі S поверхні адсорбента або на одиницю маси адсорбента т (якщо поверхню адсорбента виміряти неможливо , як, наприклад, у твердого пористого тіла):
Г= х /S; [ Г ]=моль/м2;
Г = х/ m; [ Г ]=моль/кг
