
- •1. Атомно-мол.Теория
- •2. История развития пред-й о строении атома
- •4. Совр.Предст-я о строении атомов хим.Элементов
- •5. Периодический закон и строение атомов элементов
- •6. Теоретические основы совр.Моделей строения атомов
- •7. Строение элементов 4 периода8.Строение атомов элементов 5и 6 периодов
- •10. Типы хим.Связи
- •11. Ковалентная хим.Связь
- •3.6. Полярность и поляризуемость химической связи
- •12. Механизмы образования ковалентной хим.Связи
- •13. Водородная связь.Обьекты в кот.Она присутствует.
- •14. Металлическая связь
- •15. Силы Ван-дер-Ваальса
- •16. Теория гибридизации
- •17. Делокализация связи.
- •18. Роль атомных орбиталей в обр-ии хим.Связи
- •20. Методы описания ковалентной связи.
- •1 Теория метода валентных связей
- •2.Мо лкао
17. Делокализация связи.
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи).
Такая делокализация (рассредоточение) электронов характерна для сопряженных p-связей, т.е. кратных связей, чередующихся с одинарными.
ch2=ch-ch =ch2 2 =ch-СН2 -ch=ch2 -связи
Рассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации p-электронов является p-перекрывание р-АО соседних sp2- или sp-атомов, лежащих в одной плоскости. С помощью атомно-орбитальной модели можно показать, как происходит делокализация p-связей в молекуле бутадиена. Делокализация p-электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок (см. раздел 4.7).
Примеры соединений с делокализованными связями: бензол, другие органические соединения.
Примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-.
18. Роль атомных орбиталей в обр-ии хим.Связи
Атомная орбиталь (АО) или электронное облако – это пространство вокруг ядра, в котором вероятность пребывания электрона составляет не менее 90%. АО могут различаться размерами, формой, ориентацией в пространстве.
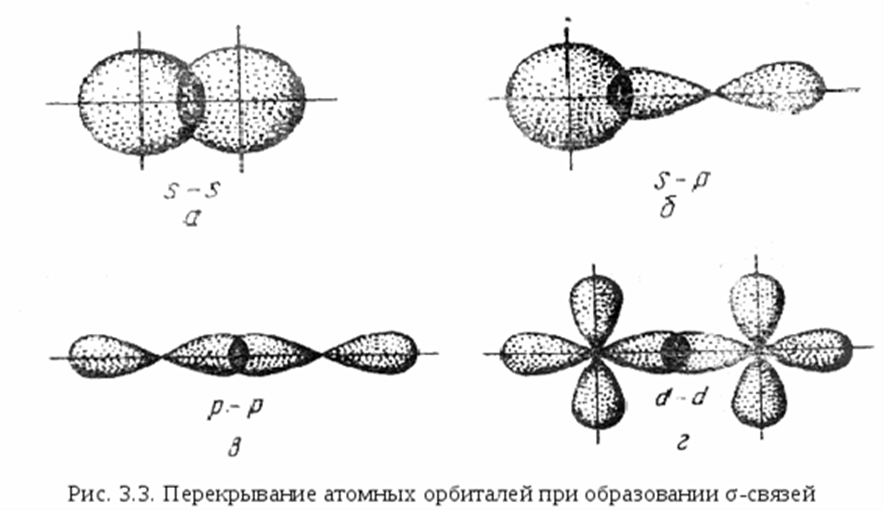
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ – связью. Сигма-связь может возникать при перекрывании s – орбиталей, s – , p – орбиталей , р – орбиталей , d – орбиталей , а также d – и s – орбиталей, и f – орбиталей с друг другом и другими орбиталями. Сигма – связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью. Простейший случай σ – связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
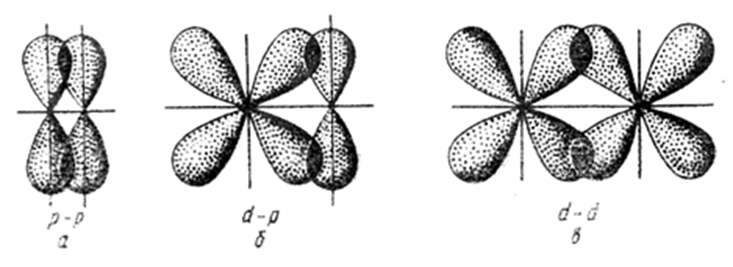
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей, p – d-орбиталей , d – d-орбиталей, а также f – p-, f – d- и f – f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью) Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи.
Кратность связи. Связь, которая образована одной электронной парой между двумя атомами, называется одинарной. Одинарная связь всегда σ – связь. При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода. Кратная связь изображается двумя черточками: О =О, С = С, О = С = О. При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в МВС называется кратностью связи.
19.
