
- •1. Атомно-мол.Теория
- •2. История развития пред-й о строении атома
- •4. Совр.Предст-я о строении атомов хим.Элементов
- •5. Периодический закон и строение атомов элементов
- •6. Теоретические основы совр.Моделей строения атомов
- •7. Строение элементов 4 периода8.Строение атомов элементов 5и 6 периодов
- •10. Типы хим.Связи
- •11. Ковалентная хим.Связь
- •3.6. Полярность и поляризуемость химической связи
- •12. Механизмы образования ковалентной хим.Связи
- •13. Водородная связь.Обьекты в кот.Она присутствует.
- •14. Металлическая связь
- •15. Силы Ван-дер-Ваальса
- •16. Теория гибридизации
- •17. Делокализация связи.
- •18. Роль атомных орбиталей в обр-ии хим.Связи
- •20. Методы описания ковалентной связи.
- •1 Теория метода валентных связей
- •2.Мо лкао
3.6. Полярность и поляризуемость химической связи
Ковалентная связь, в которой обобществленная электронная плотность (обобществленные электроны, связующее электронное облако) симметрична по отношению к ядрам взаимодействующих атомов, называется неполярной ковалентной связью. Такая связь реализуется в молекулах простых веществ, состоящих из одинаковых атомов (Н-Н, О=О, Cl-Cl, N≡N и т. д.). Она может появляться между разными атомами, обладающими одинаковой относительной электроотрицательностью.
Ковалентная связь с несимметричным распределением обобществленной электронной плотности называется полярной ковалентной связью.
Если связь образована атомами разной природы и один из атомов сильнее притягивает электроны, то обобществлённая электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Заряды атомов в молекуле, возникающие из-за различия в электроотрицательностях, называют эффективными (δ). Эффективный заряд δ можно установить экспериментально, в молекуле HCl δCl= -0,18, δн= +0,18 абсолютного заряда электрона. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) ℓ друг от друга. Мерой полярности связи служит электрический момент диполя , равный произведению эффективного заряда δ на длину диполя ℓ.
Поляризуемость характеризует способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля. В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов и образованием отрицательного и положительного ионов.
12. Механизмы образования ковалентной хим.Связи
Различают два механизма образования ковалентной связи: обменный и донорно-акцепторный.
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины(↓↑)
Спин-вектор магнитного поля. Обр-е водорода
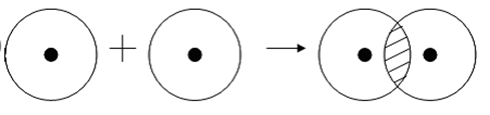
При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер.
Н ∙ + ∙ Н→Н : Н или Н ∙ + ∙ Н→Н – Н .
В общем виде для молекул АВ других веществ:
А ∙ + ∙ В = А : В .
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
В = А : В .А : +
донор акцептор
Рассмотрим механизмы образования химических связей в молекуле аммиака и ионе аммония.
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона. Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
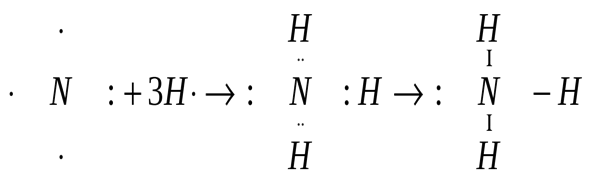
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
Образование комплексного иона – иона аммония.
NH3 + H+ = NH4+
У атома азота остается неподелённая пара электронов , т. е. два электрона с антипараллельными спинами на одной атомной орбитали.
Атом азота молекулы аммиака является донором, а ион водорода – акцептором. в ионе NH4+ все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
