
- •Вопрос 1.Роль мк в природе.
- •1)Участие в круговороте веществ.
- •Вопрос 2. Морфология бактерий
- •4)Нитевидные.
- •Вопрос 3. Методы окраски мо
- •Вопрос1. Генетическаятрансформация: трансформация, конъюгация, трансдукция.
- •Вопрос 2. Круговорот серы
- •Вопрос 3. Накопительная культура
- •Вопрос 1. Круговорот азота в биосфере
- •Вопрос 2. Отличительные особенности эукариот и прокариот
- •Вопрос 3. Методы стерилизации
- •Вопрос 1. Строение бактериальной клетки.
- •15)Донорные ворсинки(пили)-носители конъюгативных f-и r-плазмид.Поэтому имеют полость.При конъюгации пили двух бактерий соединяются. Их 1-2штуки на клетку.
- •16)Фимбрии(реснички)-прикреплены кл.Ст. Короче(0.1-12мкм) и толще(25нм).
- •17)Различные гранулы, запасаемых веществ в цитоплазме
- •Вопрос 2. Генетический аппарат мо
- •Вопрос 3.Культивирование ана- и аэробных организмов.
- •Вопрос 1. Предмет и задачи мб,этапы развития
- •Вопрос 2. Размножение бактерий
- •Вопрос 3. Назначение и методы фиксации мб препаратов
- •Вопрос 1. Строение и ф-ии клет.Стенки,хим.Состав и выявление
- •Вопрос 2. Закономерности роста популяции в период(стационар)культуры.Кривая и фазы роста.
- •Вопрос 3. Методы получения чистой кльтуры
- •Вопрос 1. Гр- мо,особенности строения кл.Ст.
- •Вопрос 2. Разновидности микроскопов,особенности,разреш.Способности,назначение
- •1)Светлопольная микроскопия
- •2)Микроскопия в темном поле
- •Вопрос 3. Посев на жидкие среды и их назначение
- •Вопрос 1. Круговорот серы
- •Вопрос 2. Рост отдельных мо и рост популяции
- •Вопрос 3. Посев на плотные питательные среды,назначение этих сред.
- •Вопрос 1. Первый этап развития мб,
- •Вопрос 2. Внехромосомные факторы наследственности
- •Вопрос 3. Метод предельных разведений.
- •III этап-Эпоха Пастера и Коха.
- •1857 Г.-Брожения. 1860 г.-Самопроизвольное зарождение. 1865 г.-Болезни вина и пива.
- •1868 Г.-Болезни шелковичных червей.1881 г. -Зараза и вакцина. 1885 г.-Предохранение от бешенства».
- •Вопрос 2. Генетический аппарат мо
- •Вопрос 3. Метод Коха.
- •Вопрос1. Современные этапы в развитии микробиологии, его особенности.
- •Вопрос 2. Непрерывные и синхронизированные структуры, способы их получения и назначения.
- •Вопрос 3. Мпб и мпа, назначение и применение.
- •1) Общего назначения – для культивирования большинства бактерий (мясопептонный агар, мясопептонный бульон, кровяной агар);
- •1) Среды специального назначения.
- •2) Общего назначения . Подходят для культивирования большинства бактерий ----а)мясопептонный агар мпа
- •Вопрос 1. Факторы среды, влияющие на рост микроорганизмов
- •Вопрос 2. Особенности ядерного аппарата у прокариот в сравнении с эукариотами.
- •Вопрос 3. Накопительные культуры , принцип элективности.
- •Вопрос 1. Строение прокариот.
- •Вопрос 2. Поступление питательных веществ в бактериальную клетку.
- •Вопрос3. Метод количественного учёта бактерий.
- •3.Определение биомассы. Чтобы определить массу сухих клеток, центрифужную пробирку или фильтр с осадком мо помещают в сушильный шкаф, высушивают и взвешивают.
- •Вопрос1. Принцип систематики и классификации бактерий.
- •1949Г-Красильников-определитель 1923г-Берджи-определитель(33группы)
- •1Морфологические признаки
- •2Тинкториальность(способность окрашиваться разными красителями)
- •3Культуральные свойства:
- •Вопрос 2.Условия культивирования микроорганизмов.
- •Вопрос 3. Строение клеточной мембраны , окраска по Граму.
- •Вопрос 1. Принцип работы лактозного оперона
- •Вопрос 2. Механизм питания бактерий
- •Вопрос 3. Способы культивирования бактерий.
- •Вопрос 1. Способы получения энергии у бактерий.
- •Вопрос 2. Питательные среды и их классификации.
- •1По составу среды подразделяются на естественные, искусственные и синтетические.
- •2По физическому состоянию среды бывают жидкие, плотные и сыпучие.
- •Вопрос 3. Этапы идентификации микроорганизмов.
- •Вопрос 1. Анаболические процессы у бактерий.
- •Вопрос 2. Круговорот азота в биосфере
- •Вопрос 3. Определение некультивируемых форм.
- •Вопрос 2. Запасные вещества бактерий и их назначение
- •Вопрос 3. Методы определения подвижности бактерий
- •3)Посевом бактерий в водный конденсат скошенного столбика агара (подвижные виды переплывают из конденсата на поверхность среды и колонизируют её).
- •Вопрос 1. Факторы патогенности бактерий.
- •Вопрос 2. Способы жизни микроорганизмов
- •Автотрофы (за счет со2)
- •Гетеротрофы (за счет углерода готовых органических соединений)
- •Вопрос 3. Общие требования,предъявляемые к пит.Средам
- •Вопрос 3. Антибиотикочувствительность
- •Вопрос 1. III этап-Эпоха Пастера и Коха.
- •1857 Г.-Брожения. 1860 г.-Самопроизвольное зарождение. 1865 г.-Болезни вина и пива.
- •1868 Г.-Болезни шелковичных червей.1881 г. -Зараза и вакцина. 1885 г.-Предохранение от бешенства».
- •Вопрос 2. Вирусы,особенности строения и функции.
- •Вопрос 2. Строение вирусов. Разнообразие вирусов.
- •Вопрос 3. Капсула бактерий,окраска капсул
- •Вопрос 3. Хранение культур бактерий.Понятие «музейная культура»
- •5)Хранение в dist. Или 1%-ном NaCl.Мо предварительно выращивают в оптимальных условиях, после чего клетки суспендируют в дистиллированной воде или 1%-ном растворе хлорида натрия.
- •Вопрос 1. Круговорот серы
- •Вопрос 2. Принцип работы лактозного оперона
- •Вопрос 3. Методы диагностики вирусов
- •1)Культуры клеток для выявления вирусов
- •4)Появление гигантских многоядерных клеток и др;
- •Вопрос 1. Круговорот азота в биосфере
- •Вопрос 2. Понятие и классификация вирусов. (см 21 и 22 билет)
- •Ictv классификация
- •Вопрос 1. Археи,история изучения,место в биолог.Мегасистеме
- •1)Формы клеток архебактерий в целом сходны с таковыми эубактерий(есть кокки, палочки, извитые). 2)Особенность архебактерий — отсутствие сложных многоклеточных форм, мицелиальных и трихомных.
- •Вопрос 2. Понятие вирусной инфекции. Экология вирусов
- •Вопрос 3. Методы микроскопии в мб
Вопрос 3. Метод Коха.
Метод широко применяют для определения численности жизнеспособных клеток в различных естественных субстратах и в лабораторных культурах. В его основе лежит принцип Коха, согласно которому каждая колония является потомством одной клетки. Это позволяет на основании числа колоний, выросших после посева на плотную питательную среду определенного объема исследуемой суспензии, судить об исходном содержании в ней клеток микроорганизмов. Результаты количественного учета микроорганизмов, проведенного методом Коха, часто выражают не в числе клеток, а в условных единицах — так называемых колониеобразующих единицах (КОЕ). Определение числа микроорганизмов этим методом включает три этапа: приготовление разведений, посев на плотную среду в чашки Петри и подсчет выросших колоний.
Приготовление разведений. Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или 0,85%-ном растворе физрастворе. В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1 мл исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 мл стерильной воды — это 1-е разведение, 10-1. Полученное разведение тщательно перемешивают новой стерильной пипеткой, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3—5 раз, затем той же пипеткой отбирают 1 мл полученной суспензии и переносят во 2-ю пробирку — получают 2-е разведение (10~2). Таким же образом готовят и последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов; соответственно она тем больше, чем больше плотность популяции.
Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата.
Посев. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом разливают расплавленную, чаще всего агаризованную, питательную среду в ряд стерильных чашек Петри по 15—20 мл в каждую Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхность агаризованных сред перед посевом рекомендуется подсушивать для удаления конденсационной воды.
Среду можно подсушить, поместив чашки в термостат на 2—3 суток крышками вниз. После того как среда готова, на ее поверхность стерильной пипеткой наносят точно измеренный объем (0,05 или 0,1 мл) соответствующего разведения и распределяют его стерильным стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают 2—4 параллельных высева. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель. После посева чашки Петри помещают в термостат крышками вниз.
При глубинном посеве точно измеренный объем (как правило 0,1, 0,5 или 1,0 мл) исходной суспензии или разведения вносят в расплавленную и остуженную до 48—50° агаризованную среду, тщательно перемешивают и затем немедленно выливают в чашку Петри Среде дают застыть. В случае глубинного посева пользуются средой, разлитой в пробирки. При больших масштабах работы среду по пробиркам не разливают, а поступают следующих образом. По 1 мл из соответствующего разведения переносят стерильной пипеткой в 2—4 стерильные чашки Петри. Затем заливают чашки 15—20 мл расплавленной и остуженной до 48—50° плотной средой и тщательно смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Для определения количества клеток анаэробных микроорганизмов чашки Петри с плотной средой после посева помещают в анаэростаты. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают парафином. Для лучшего рассмотрения колоний микроорганизмов среды в этом случае рекомендуется осветлять. Определение численности экстремальных анаэробов требует применения техники Хангейта.
Подсчет выросших колоний. Колонии микроорганизмов в зависимости от скорости роста подсчитывают через 2—15 суток инкубации. Подсчет, как правило, проводят, не открывая чашек Петри. Для удобства каждую просчитанную колонию отмечают точкой на наружной стороне дна чашки. При большом количестве колоний дно чашки Петри делят на секторы, просчитывают колонии в каждом секторе и суммируют результаты. Иногда для подсчета колоний используют специальные полуавтоматические счетчики.
Лучшим разведением следует считать то, при высеве из которого в чашке Петри вырастает от 30—50 до 100—150 колоний. Если число выросших колоний оказалось меньше 10, то эти результаты для расчета количества клеток в исходном материале не используют. Результаты параллельных высевов из одного и того же разведения суммируют и определяют среднее число колоний, выросший при высеве из разведения на одной чашке.
Количество клеток в 1 мл исследуемого субстрата вычисляют по формуле
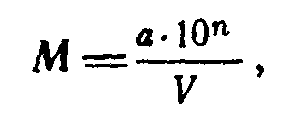
где М — количество клеток в 1 мл; а — среднее число колоний при высеве разведения, из которого сделан высев; V — объем суспензии, взятый для посева, в мл; 10" — коэффициент разведений.
Билет №11
