
- •Вопрос 1.Роль мк в природе.
- •1)Участие в круговороте веществ.
- •Вопрос 2. Морфология бактерий
- •4)Нитевидные.
- •Вопрос 3. Методы окраски мо
- •Вопрос1. Генетическаятрансформация: трансформация, конъюгация, трансдукция.
- •Вопрос 2. Круговорот серы
- •Вопрос 3. Накопительная культура
- •Вопрос 1. Круговорот азота в биосфере
- •Вопрос 2. Отличительные особенности эукариот и прокариот
- •Вопрос 3. Методы стерилизации
- •Вопрос 1. Строение бактериальной клетки.
- •15)Донорные ворсинки(пили)-носители конъюгативных f-и r-плазмид.Поэтому имеют полость.При конъюгации пили двух бактерий соединяются. Их 1-2штуки на клетку.
- •16)Фимбрии(реснички)-прикреплены кл.Ст. Короче(0.1-12мкм) и толще(25нм).
- •17)Различные гранулы, запасаемых веществ в цитоплазме
- •Вопрос 2. Генетический аппарат мо
- •Вопрос 3.Культивирование ана- и аэробных организмов.
- •Вопрос 1. Предмет и задачи мб,этапы развития
- •Вопрос 2. Размножение бактерий
- •Вопрос 3. Назначение и методы фиксации мб препаратов
- •Вопрос 1. Строение и ф-ии клет.Стенки,хим.Состав и выявление
- •Вопрос 2. Закономерности роста популяции в период(стационар)культуры.Кривая и фазы роста.
- •Вопрос 3. Методы получения чистой кльтуры
- •Вопрос 1. Гр- мо,особенности строения кл.Ст.
- •Вопрос 2. Разновидности микроскопов,особенности,разреш.Способности,назначение
- •1)Светлопольная микроскопия
- •2)Микроскопия в темном поле
- •Вопрос 3. Посев на жидкие среды и их назначение
- •Вопрос 1. Круговорот серы
- •Вопрос 2. Рост отдельных мо и рост популяции
- •Вопрос 3. Посев на плотные питательные среды,назначение этих сред.
- •Вопрос 1. Первый этап развития мб,
- •Вопрос 2. Внехромосомные факторы наследственности
- •Вопрос 3. Метод предельных разведений.
- •III этап-Эпоха Пастера и Коха.
- •1857 Г.-Брожения. 1860 г.-Самопроизвольное зарождение. 1865 г.-Болезни вина и пива.
- •1868 Г.-Болезни шелковичных червей.1881 г. -Зараза и вакцина. 1885 г.-Предохранение от бешенства».
- •Вопрос 2. Генетический аппарат мо
- •Вопрос 3. Метод Коха.
- •Вопрос1. Современные этапы в развитии микробиологии, его особенности.
- •Вопрос 2. Непрерывные и синхронизированные структуры, способы их получения и назначения.
- •Вопрос 3. Мпб и мпа, назначение и применение.
- •1) Общего назначения – для культивирования большинства бактерий (мясопептонный агар, мясопептонный бульон, кровяной агар);
- •1) Среды специального назначения.
- •2) Общего назначения . Подходят для культивирования большинства бактерий ----а)мясопептонный агар мпа
- •Вопрос 1. Факторы среды, влияющие на рост микроорганизмов
- •Вопрос 2. Особенности ядерного аппарата у прокариот в сравнении с эукариотами.
- •Вопрос 3. Накопительные культуры , принцип элективности.
- •Вопрос 1. Строение прокариот.
- •Вопрос 2. Поступление питательных веществ в бактериальную клетку.
- •Вопрос3. Метод количественного учёта бактерий.
- •3.Определение биомассы. Чтобы определить массу сухих клеток, центрифужную пробирку или фильтр с осадком мо помещают в сушильный шкаф, высушивают и взвешивают.
- •Вопрос1. Принцип систематики и классификации бактерий.
- •1949Г-Красильников-определитель 1923г-Берджи-определитель(33группы)
- •1Морфологические признаки
- •2Тинкториальность(способность окрашиваться разными красителями)
- •3Культуральные свойства:
- •Вопрос 2.Условия культивирования микроорганизмов.
- •Вопрос 3. Строение клеточной мембраны , окраска по Граму.
- •Вопрос 1. Принцип работы лактозного оперона
- •Вопрос 2. Механизм питания бактерий
- •Вопрос 3. Способы культивирования бактерий.
- •Вопрос 1. Способы получения энергии у бактерий.
- •Вопрос 2. Питательные среды и их классификации.
- •1По составу среды подразделяются на естественные, искусственные и синтетические.
- •2По физическому состоянию среды бывают жидкие, плотные и сыпучие.
- •Вопрос 3. Этапы идентификации микроорганизмов.
- •Вопрос 1. Анаболические процессы у бактерий.
- •Вопрос 2. Круговорот азота в биосфере
- •Вопрос 3. Определение некультивируемых форм.
- •Вопрос 2. Запасные вещества бактерий и их назначение
- •Вопрос 3. Методы определения подвижности бактерий
- •3)Посевом бактерий в водный конденсат скошенного столбика агара (подвижные виды переплывают из конденсата на поверхность среды и колонизируют её).
- •Вопрос 1. Факторы патогенности бактерий.
- •Вопрос 2. Способы жизни микроорганизмов
- •Автотрофы (за счет со2)
- •Гетеротрофы (за счет углерода готовых органических соединений)
- •Вопрос 3. Общие требования,предъявляемые к пит.Средам
- •Вопрос 3. Антибиотикочувствительность
- •Вопрос 1. III этап-Эпоха Пастера и Коха.
- •1857 Г.-Брожения. 1860 г.-Самопроизвольное зарождение. 1865 г.-Болезни вина и пива.
- •1868 Г.-Болезни шелковичных червей.1881 г. -Зараза и вакцина. 1885 г.-Предохранение от бешенства».
- •Вопрос 2. Вирусы,особенности строения и функции.
- •Вопрос 2. Строение вирусов. Разнообразие вирусов.
- •Вопрос 3. Капсула бактерий,окраска капсул
- •Вопрос 3. Хранение культур бактерий.Понятие «музейная культура»
- •5)Хранение в dist. Или 1%-ном NaCl.Мо предварительно выращивают в оптимальных условиях, после чего клетки суспендируют в дистиллированной воде или 1%-ном растворе хлорида натрия.
- •Вопрос 1. Круговорот серы
- •Вопрос 2. Принцип работы лактозного оперона
- •Вопрос 3. Методы диагностики вирусов
- •1)Культуры клеток для выявления вирусов
- •4)Появление гигантских многоядерных клеток и др;
- •Вопрос 1. Круговорот азота в биосфере
- •Вопрос 2. Понятие и классификация вирусов. (см 21 и 22 билет)
- •Ictv классификация
- •Вопрос 1. Археи,история изучения,место в биолог.Мегасистеме
- •1)Формы клеток архебактерий в целом сходны с таковыми эубактерий(есть кокки, палочки, извитые). 2)Особенность архебактерий — отсутствие сложных многоклеточных форм, мицелиальных и трихомных.
- •Вопрос 2. Понятие вирусной инфекции. Экология вирусов
- •Вопрос 3. Методы микроскопии в мб
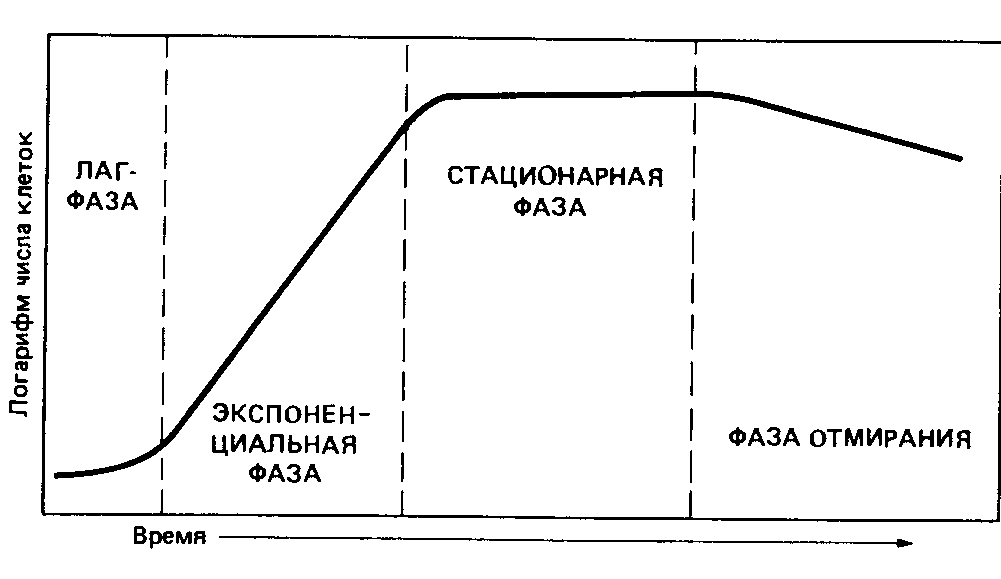
Вопрос 2. Закономерности роста популяции в период(стационар)культуры.Кривая и фазы роста.
При внесении бактерий в питательную среду они обычно растут до тех пор, пока содержание какого-нибудь из необходимых компонентов среды не достигнет min , после чего рост прекращается. Если на протяжении этого времени не добавлять питательных веществ и не удалять конечных продуктов обмена, то получим -периодическую культуру (популяцию клеток в ограниченном жизненном пространстве).
 Периодическая
культура ведет себя как многоклеточный
организм с генетически ограниченным
ростом.
Периодическая
культура ведет себя как многоклеточный
организм с генетически ограниченным
ростом.
Кривая, описывающая зависимость логарифма числа живых клеток от времени, называется-кривой роста.
ФАЗЫ: 1)начальную (или лаг-) фазу,2) экспоненциальную (логарифмическую) фазу, 3)стационарная фаза,4)фаза отмирания.
1)Начальная(лаг) фаза адаптации- промежуток времени между инокуляцией и достижением max скорости деления. Продолжительность зависит от предшествовавших условий культивирования ,возраста инокулята,и от того, насколько пригодна для роста данная среда. Количественное изменение состава бактериальной клетки во время начальной фазы роста сильнее всего затрагивает РНК: содержание РНК повышается в 8-12 раз. Это указывает на участие РНК и рибосом в синтезе ферментных белков.
2)Экспоненциальная(логарифмическая)фаза-постоянная max скоростью деления. Скорость зависит от вида бактерий,и от среды. Величина клеток и содержание в них белка у многих бактерий тоже остаются в экспоненциальной фазе постоянными.Можно сказать, что бактериальная культура в этом случае состоит из «стандартных клеток». Нередко, клетки периодической культуры претерпевают изменения, так как постепенно изменяется среда: уменьшается концентрация субстрата, увеличивается плотность клеточной суспензии и накапливаются продукты обмена.МО здесь самые уязвимые.
3)Стационарная фаза-наступает, когда число клеток перестает увеличиваться. Скорость роста зависит от концентрации субстрата. Поэтому переход от экспоненциальной фазы к стационарной происходит постепенно. Скорость роста снижается из-за нехватки субстрата,из-за большой плотности популяции,из-за низкого парциального давления 02 или накопления токсичных продуктов обмена; все эти факторы вызывают переход к стационарной фазе.Могут еще происходить использование запасных веществ, распад части рибосом и синтез ферментов. Урожай(выход)-количество биомассы, достигнутое в стационарной фазе.
4)Фаза отмирания. Фаза отмирания и причины гибели бактериальных клеток в нормальных питательных средах изучены недостаточно. Сравнительно легко понять случаи, когда в среде накапливаются кислоты (при росте Escherichia, Lactobacillus). Число живых клеток может снижаться экспоненциально. Иногда клетки лизируются под действием собственных ферментов.
Вопрос 3. Методы получения чистой кльтуры
А-Выделение чистой культуры из отдельной колонии
Это основной метод выделения чистых культур мо, предложенный Р. Кохом. Принцип- получение чистой культуры из отдельной колонии. Однако этот метод неприменим для выделения мо, которые не растут или плохо растут на плотных средах(некоторые бактерии, многие водоросли и простейшие).
При выделении чистой культуры аэробов накопительную культуру высевают на поверхность плотной среды. Порядок работы следующий. Расплавленную на кипящей водяной бане стерильную питательную среду, содержащую агар или желатину, разливают в стерильные чашки Петри. Когда среда застынет, на ее поверхность из пипетки наносят каплю накопительной культуры или ее разведения в стерильной воде и стерильным стеклянным шпателем Дригальского распределяют каплю сначала по одной половине поверхности среды в чашке Петри,затем по второй половине, после чего этим же шпателем протирают поверхность плотной среды последовательно во 2-й, 3-й и 4-й чашках. Обычно в первых двух чашках после инкубации наблюдают сплошной рост мо,а в последующих — изолированные колонии. Рассевать накопительную к-ру можно петлей методом истощающего штриха. В этом случае накопительную к-ру или ее разведение отбирают петлей и на поверхности .плотной среды проводят штрихи в таком порядке, как указано на рис. Перед каждым новым штрихом петлю стерилизуют в пламени горелки.
После посева чашки помещают в термостат крышками вниз,чтобы конденсационная вода, образовавшаяся на крышке чашки Петри при застывании агара, не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 1—7 суток в зависимости от скорости роста мо. Выросшие изолированные колонии отсевают петлей на поверхность скошенной плотной среды в пробирки или в жидкую среду.
И золированные
колонии аэротолерантных мо и факультативных
анаэробов чаще получают методом
глубинного досева.
Для этого плотную питательную среду
предварительно разливают в пробирки
по 15—20 мл и стерилизуют. Непосредственно
перед посевом пробирки помещают в
кипящую водяную баню, чтобы среда
расплавилась. Высев проводят из разведений
накоп-ой к-ры в стерильной водопроводной
воде. Разведения готовят с таким
расчетом, чтобы при высеве 0,5—1,0 мл
разведения получить изолированные
колонии. Степень разведения определяется
плотностью накоп-ой к-ры. Высевы
делают, как правило, из 3-4х последних
разведений. Для этого в пробирку с
расплавленной и остуженной до
48—50°агаризованной средой вносят 0,5—1,0
мл одного из разведений накопительной
культуры. Посевной материал тщательно
перемешивают, вращая пробирку между
ладонями. Затем около пламени горелки
вынимают из пробирки пробку, обжигая
края пробирки в пламени горелки, и
быстро выливают содержимое пробирки в
чашку Петри. После того как агаризованная
среда застынет, чашки Петри помещают
в термостат. Колонии, выросшие в толще
среды, вырезают стерильным скальпелем
или извлекают стерильными капиллярными
трубками или просто петлей и переносят
в жидкую среду.
золированные
колонии аэротолерантных мо и факультативных
анаэробов чаще получают методом
глубинного досева.
Для этого плотную питательную среду
предварительно разливают в пробирки
по 15—20 мл и стерилизуют. Непосредственно
перед посевом пробирки помещают в
кипящую водяную баню, чтобы среда
расплавилась. Высев проводят из разведений
накоп-ой к-ры в стерильной водопроводной
воде. Разведения готовят с таким
расчетом, чтобы при высеве 0,5—1,0 мл
разведения получить изолированные
колонии. Степень разведения определяется
плотностью накоп-ой к-ры. Высевы
делают, как правило, из 3-4х последних
разведений. Для этого в пробирку с
расплавленной и остуженной до
48—50°агаризованной средой вносят 0,5—1,0
мл одного из разведений накопительной
культуры. Посевной материал тщательно
перемешивают, вращая пробирку между
ладонями. Затем около пламени горелки
вынимают из пробирки пробку, обжигая
края пробирки в пламени горелки, и
быстро выливают содержимое пробирки в
чашку Петри. После того как агаризованная
среда застынет, чашки Петри помещают
в термостат. Колонии, выросшие в толще
среды, вырезают стерильным скальпелем
или извлекают стерильными капиллярными
трубками или просто петлей и переносят
в жидкую среду.
Особые трудности возникают при выделении чистых культур облигатных анаэробов. Если контакт с молекулярным кислородом не вызывает сразу же гибели клеток, то посев проводят на поверхность среды в чашки Петри, но после посева чашки тотчас помещают в анаэростат. Однако чаще пользуются методом разведения-разведения накоп-ой к-ры проводят в расплавленной и охлажденной до 45—50° агаризованной питательной среде. Делают 6—10 последовательных разведений. Затем среду в пробирках быстро охлаждают и заливают поверхность слоем стерильной смеси парафина и вазелинового масла (3:1), что препятствует проникновению воздуха в толщу агаризованной среды.
Иногда агаризаванную питательную среду после посева и тщательного перемешивания переносят в стерильные трубки Бурри. Можно использовать капиллярные пипетки Пастера, в которые набирают соответствующее разведение накопительной культуры в расплавленной агаризованной питательной среде. Конец капилляра запаивают. При удачно выбранном разведении накопительной культуры в одной из пробирок (пипеток Пастера, трубок Бурри) вырастают изолированные колонии. Извлечение образовавшихся колоний- а)удаляют стерильной иглой слой парафина и вазелинового масла, а столбик агаризованной среды выдувают из пробирки в стерильную чашку Петри, пропуская газ, не содержащий кислорода, через капилляр, который помещают между стенкой пробирки и агаризованной средой. Агаризованную среду из трубки Буррл выдувают, пропуская газ через ватную пробку.
б)робирку слегка нагревают, все время быстро вращая ее над пламенем горелки. При этом агар, непосредственно прилегающий к стенке, плавится и содержимое пробирки в виде агарового столбика легко выскальзывает в стерильную чашку Петри. Столбик агара разрезают стерильным ланцетом и извлекают колонии, захватывая их стерильными капиллярными трубками или петлей. Можно также вырезать их стерильным ланцетом. Извлеченные колонии переносят в жидкую среду. Если изолированные колонии получены в капилляре, то после тщательной дезинфекции поверхности его разламывают стерильным пинцетом и участки капилляра, содержащие изолированные колонии, переносят в стерильную среду.
Для получения изолированных колоний методом глубинного посева и методом разведений рекомендуется использовать осветленные питательные среды.
Получение изолированных колоний анаэробов,- используют метод вращающихся пробирок Хангейта. (сущность)- расплавленную агаризованную среду засевают бактериями при постоянном токе через пробирку инертного газа, освобожденного от кислорода. Затем пробирку закрывают резиновой пробкой и помещают горизонтально в зажим, вращающий пробирку. Агаризованная среда при этом равномерно распределяется по стенкам пробирки и застывает тонким слоем. Применение тонкого слоя агаризованной среды в пробирке, заполненной газовой смесью, позволяет получить изолированные колонии, хорошо видимые невооруженным глазом.
Чаще посев в плотную питательную среду повторяют 2—3 раза.
Б-Выделение чистой культуры из одной клетки
Капельный метод Линднера -с помощью микроманипулятора или микроселектора.Используют при работе с дрожжами, мицелиальными грибами, водорослями. Порядок работы . Накопительную культуру разводят в стерильной среде с таким расчетом, чтобы в небольшой капле были одиночные клетки мо. Затем на поверхность стерильного покровного стекла стерильным стальным пером наносят ряд капель приготовленного разведения. Готовят препарат «висячая капля». Нанесенные на покровное стекло капли просматривают под микроскопом и отмечают те, в которых обнаружена только одна клетка. После этого препарат помещают в термостат во влажную камеру, которой обычно служит чашка Петри с увлажненной фильтровальной бумагой на дне. Через 12—24 ч отмеченные капли вновь микроскопируют. Те, в. которых наблюдается образование микроколоний,снимают с покровного стекла кусочками стерильной фильтровальной бумаги и переносят в пробирки со стерильной средой.
Выделение отдельных клеток с помощью микроманипулятора Перфильева -Микроманипулятор — прибор, позволяющий с помощью специальной микропипетки или микропетли извлекать одну клетку из суспензии. Эту операцию контролируют под микроскопом. Микроманипулятор имеет два операционных штатива, между которыми расположен обычный микроскоп. На предметном столике микроскопа установлена влажная камера, в которую помещают препарат «висячая капля». В держателях операционных штативов закреплены микропипетки (микропетли), перемещение которых в поле зрения микроскопа осуществляется с микронной точностью благодаря системе винтов и рычагов. Микропипетки вводят во влажную камеру так, чтобы их концы оказались в висячей капле. Исследователь, глядя в микроскоп, извлекает отдельные клетки микропипетками и переносит их в пробирки со стерильной жидкой средой.
ОПРЕДЕЛЕНИЕ ЧИСТОТЫ ВЫДЕЛЕННОЙ КУЛЬТУРЫ
визуальным, микроскопическим контролем и высевом на ряд питательных сред. а)визуальный контроль -просматривается рост мо по штриху на поверхности скошенной агаризованной среды. Если рост по штриху неоднороден, культура загрязнена. Такой контроль возможен только для культур, способных расти на поверхности плотных сред.
б)под микроскопом-готовят препарат фиксированных окрашенных клеток и смотрят его с иммерсионной системой или препарат живых клеток и смотрят его, используя фазово-контрастное устройство.в)высев на питательные среды-выделенную культуру высевают на питательную среду, благоприятную для ее роста. Однородность выросших колоний — свидетельство чистоты культуры. Обязателен посев на мясопептонный агар. Критерием чистоты-однородность выросших колоний или отсутствие роста, если данные мо на МПА не развиваются.
Билет №7
