
- •1.)Визначення молярної , відносних молекулярної та атомної мас речовини .
- •4.)Сформулюйте закон Авогадро та його наслідки та визначіть можливість
- •5.)Наведіть сучасне формулюваня Периодичного закону і поясніть його зв‘язок з
- •6.)Сформулюйте основні положення квантової механіки.Поясніть, як вони
- •7.)Поясніть фізичний зміст функції, яка є рішенням хвильового рівняння
- •8.)Поясніть поняття Атомна орбіталь . Вкажіть параметри, які її однозначно
- •9.)Поясніть звязок між значенням головного квантового числа для хімічноо
- •10.)Поясніть зв‘язок між значенням орбітального квантового числа для хімічного
- •11.)Поясніть звязок між значенням магнітного квантового числа для хімічного
- •13.)Використовуючи принцип найменьшої енергії , поясніть, в якому порядку
- •16.)Поясніть, чому виникає збудженний стан атому і як при цьому змінюється
- •17.)Поясніть, які атоми проявляють металічні властивості та вкажіть місце їх
- •18.)Поясніть, атоми яких хімічних елементів проявляють неметалічні
- •19.)Вкажіть параметри, які характеризують хімічний зв'язок. Поясніть, як
- •20.)Поясніть різницу в утворенні рівноцінного і донорно –акцепторного зв‘язку.
- •21.)Поясніть причини виникнення гібридизації при утворенні хімічних зв‘язків
- •22. ) Поясніть принцип виникнення міжмолекулярної взаємодії, дайте
- •23. )Дайте характеристику різних типів кристалічних граток, наведіть приклади.
- •24. )Вкажіть параметри , які характеризують термодинамічний стан системи.
- •25.)На прикладі реакції горіння вугілля покажіть відмінність між хімічними та
- •26.)Обгрунтуйте використання закона Гесса для рзрахунку теплового ефекту
- •27.)Поясніть зв‘язок між зміною ентропії системи за зміною температури і
- •28.)Поясніть відмінність між відкритою та ізольованою термодинамічною
- •29.)Поясніть, за якою термодинамічною функцією визначається можливість
- •30.)Перерахуйте фактори, від яких залежить швидкість хімічної реакції.
- •(K)Константа швидкості хімічної реакції не залежить від концентрації та тиску.
- •31.)Поясніть, виразом якого закону є кінетичне рівняння .
- •32.)Використовуючи рівняння Арреніуса та теорію активних зіткнень, поясніть
- •33.)Використовуючи теорію активованого комплексу, поясніть механізм дії
- •34.)Вкажіть фактори, які можуть змінити стан хімічної рівноваги .
- •36.)Перелічіть кількістні характеристикі процесу електричної дисоціації.
- •37.)Поясніть обернено –пропорційну залежність ступеня дисоціації електроліту і
- •38.)Поясніть, в якому напрямку відбуваюся реакціі між розчинами електролітів.
- •39.)Поясніть причини виникнення гідролізу солей.
- •40.)Наведіть рівняння гідролізу солей, що містять іони слабких електоролітів.
- •43.)Вкажіть склад електрохімічноі системи .Вкажіть зовнішній і внутрішній ланцюг. Склад електорхімічної системи:
- •44.)Візначіть склад металічних електродів першого роду, складіть загальну
- •45.)Визначіть склад металічних електродів другого роду, складіть загальну
- •46.)Визначіть склад газових (водневого та кисневого) електордів, складіть
- •49.)Вкажіть склад комбінованого гальванічного елементу ,анодний та катодний
- •50.)Поясніть, чому напруга гальванічного елемента відрізняється від
- •51. )Дайте характеристику поляризації гальванічного елемента.
- •52.) Дайте характеристику та класифікацію корозійних процесів.
- •53.)Визначіть причини гальванокорозіі та способи захисту від корозії .
- •54. ) Вкажіть склад корозійного гальванічного елементу, рівняння анодного і
- •55.)Опишіть принцип роботи електрохімічних батарейок ,склад електрохімічної
- •56.)Поясніть принцип роботи свинцевого акумулятора ,наведіть рівняння
- •57.)Поясніть принцип роботи паливних елементів , наведіть рівняння анодного і
- •58.)Визначіть анодні та катодні процеси під час атмосферної корозії сталі.
- •60.)Визначіть закономірності процесів відновлення та окиснення частинок під час електролізу.
24. )Вкажіть параметри , які характеризують термодинамічний стан системи.
Поясніть, між якими параметрами встановлює зв‘язок 1 закон термодинаміки .
Термодинамічні системи характеризуються, з одного боку, параметрами стану, з іншої- функціями стану. Параметри стану - це незалежні змінні характеристики
термодинамічної системи (хімічний склад, маса, температура (Т), об'єм (V), тиск (Р)).
1 закон термодинаміки : кількість підведеної теплоти дорівнює сумі виконаної роботи та зміні внутрішньої енергії системи. Таким чином 1 закон термодинаміки встановлює зв'язок між кількістю теплоти, тобто температурою, роботою, яка виконується проти зовнішніх сил, тобто тиску, а це означає і об’ємом, а також, якщо розписати рівняння роботи А=m×a, можна побачити, що він виражає зв'язок із масою. Таким чином перший закон термодинаміки виражає зв'язок між температурою, тиском, об’ємом та масою.
25.)На прикладі реакції горіння вугілля покажіть відмінність між хімічними та
термохімічними рівняннями реакції. Реакція горіння вугіллля:С+O2→CO2
26.)Обгрунтуйте використання закона Гесса для рзрахунку теплового ефекту
хімічноі реакції . Другий закон термохімії відкрив російський хімік Г.І.Гесс:
Тепловий ефект хімічної реакції залежить від виду і стану реагуючих речовин і продуктів реакції, але не залежить від шляху(проміжних стадій),по якому йде процес.Наслідки:
-Тепловий ефект реакції дорівнює сумі стандартних ентальпій утворення продуктів, за вирахуванням суми стандартних ентальпій утворення реагентів, з урахуванням числа їхніх молів.
-Термохімічні рівняння можна додавати або віднімати разом з їхніми тепловими ефектами,як алгебраїчні рівняння.
-Якщо в двох реакціях з різних речовин утворюються однакові продукти,то різниця теплових ефектів цих реакцій дорівнює тепловому ефекту переходу від одних вихідних речовин до інших.(З одного агрегатного стану в інший)
Закон Гесса,та його наслідки застосовують для обчислення теплових ефектів зокрема в тому випадку,коли експериментально ∆H виміряти не можна.Для цього використовують 2 різних методи:1)Можна додавати або віднімати термохімічні рівняння з відомими тепловими ефектами так ,щоб одержати рівняння з шуканим тепловим ефектом.
Прикладом може бути визначення теплоти перетворення графіту на алмаз, для знаходження якого необхідно відняти теплоти згорання модифікацій вуглецю.
2)Найчастіше використовується метод циклів,який полягає в тому,що реакцію,тепловий ефект якої необхідно знайти ,розбивають на декілька стадій з відомими значеннями ентальпій.А шукане значення ∆H рівне сумі ∆H проміжних стадій.
27.)Поясніть зв‘язок між зміною ентропії системи за зміною температури і
кількості частинок в системі .
(S)Ентропія,[Дж/моль∙К]-термодинамічна функція,яка є кількісною мірою невпорядкованості системи.Чим більше значення S тим більша невпорядкованість системи,тим більш вірогідним є даний стан системи.Тому
S(суміші газів)>> S(окремих газів)>>S(рідини)>>S(твердого тіла).
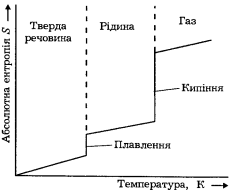 М.Планк
обгрунтував постулат за яким:Ентропія
кристалічних тіл за температури
абсолютного нуля рівна нулю.Це означає,що
в ідеальному кристалі за 0 К рух атомів
відсутній,атоми перебувають відносно
один одного в певних,точно визначених
позиціях.Ентропія за таких умов рівна
нулю.У міру підвищення температури
розпочинається і дедалі посилюється
коливальний рух атомів,внаслідок чого
змінюється їх взаємне розміщення,тобто
поява нових мікростанів,що веде за собою
поступове зростання ентропії системи
до точки плавлення.Під час плавлення
кристала до коливального руху додається
ще поступальний,’’дальній порядок’’
у розміщенні частинок змінюється на
’’ближній порядок’.За температури
плавлення відбувається стрибкоподібне
зростання ентропії речовини.У разі
нагрівання розплаву твердої речовини
його температура підвищується ,і водночас
плавно зростає ентропія.За температури
кипіння знову різко зростає ентропія,що
здебільшого зумовлено різким збільшенням
об’єму,пов’язане з переходом з рідкого
стану в газоподібний .
М.Планк
обгрунтував постулат за яким:Ентропія
кристалічних тіл за температури
абсолютного нуля рівна нулю.Це означає,що
в ідеальному кристалі за 0 К рух атомів
відсутній,атоми перебувають відносно
один одного в певних,точно визначених
позиціях.Ентропія за таких умов рівна
нулю.У міру підвищення температури
розпочинається і дедалі посилюється
коливальний рух атомів,внаслідок чого
змінюється їх взаємне розміщення,тобто
поява нових мікростанів,що веде за собою
поступове зростання ентропії системи
до точки плавлення.Під час плавлення
кристала до коливального руху додається
ще поступальний,’’дальній порядок’’
у розміщенні частинок змінюється на
’’ближній порядок’.За температури
плавлення відбувається стрибкоподібне
зростання ентропії речовини.У разі
нагрівання розплаву твердої речовини
його температура підвищується ,і водночас
плавно зростає ентропія.За температури
кипіння знову різко зростає ентропія,що
здебільшого зумовлено різким збільшенням
об’єму,пов’язане з переходом з рідкого
стану в газоподібний .
