
- •1.)Визначення молярної , відносних молекулярної та атомної мас речовини .
- •4.)Сформулюйте закон Авогадро та його наслідки та визначіть можливість
- •5.)Наведіть сучасне формулюваня Периодичного закону і поясніть його зв‘язок з
- •6.)Сформулюйте основні положення квантової механіки.Поясніть, як вони
- •7.)Поясніть фізичний зміст функції, яка є рішенням хвильового рівняння
- •8.)Поясніть поняття Атомна орбіталь . Вкажіть параметри, які її однозначно
- •9.)Поясніть звязок між значенням головного квантового числа для хімічноо
- •10.)Поясніть зв‘язок між значенням орбітального квантового числа для хімічного
- •11.)Поясніть звязок між значенням магнітного квантового числа для хімічного
- •13.)Використовуючи принцип найменьшої енергії , поясніть, в якому порядку
- •16.)Поясніть, чому виникає збудженний стан атому і як при цьому змінюється
- •17.)Поясніть, які атоми проявляють металічні властивості та вкажіть місце їх
- •18.)Поясніть, атоми яких хімічних елементів проявляють неметалічні
- •19.)Вкажіть параметри, які характеризують хімічний зв'язок. Поясніть, як
- •20.)Поясніть різницу в утворенні рівноцінного і донорно –акцепторного зв‘язку.
- •21.)Поясніть причини виникнення гібридизації при утворенні хімічних зв‘язків
- •22. ) Поясніть принцип виникнення міжмолекулярної взаємодії, дайте
- •23. )Дайте характеристику різних типів кристалічних граток, наведіть приклади.
- •24. )Вкажіть параметри , які характеризують термодинамічний стан системи.
- •25.)На прикладі реакції горіння вугілля покажіть відмінність між хімічними та
- •26.)Обгрунтуйте використання закона Гесса для рзрахунку теплового ефекту
- •27.)Поясніть зв‘язок між зміною ентропії системи за зміною температури і
- •28.)Поясніть відмінність між відкритою та ізольованою термодинамічною
- •29.)Поясніть, за якою термодинамічною функцією визначається можливість
- •30.)Перерахуйте фактори, від яких залежить швидкість хімічної реакції.
- •(K)Константа швидкості хімічної реакції не залежить від концентрації та тиску.
- •31.)Поясніть, виразом якого закону є кінетичне рівняння .
- •32.)Використовуючи рівняння Арреніуса та теорію активних зіткнень, поясніть
- •33.)Використовуючи теорію активованого комплексу, поясніть механізм дії
- •34.)Вкажіть фактори, які можуть змінити стан хімічної рівноваги .
- •36.)Перелічіть кількістні характеристикі процесу електричної дисоціації.
- •37.)Поясніть обернено –пропорційну залежність ступеня дисоціації електроліту і
- •38.)Поясніть, в якому напрямку відбуваюся реакціі між розчинами електролітів.
- •39.)Поясніть причини виникнення гідролізу солей.
- •40.)Наведіть рівняння гідролізу солей, що містять іони слабких електоролітів.
- •43.)Вкажіть склад електрохімічноі системи .Вкажіть зовнішній і внутрішній ланцюг. Склад електорхімічної системи:
- •44.)Візначіть склад металічних електродів першого роду, складіть загальну
- •45.)Визначіть склад металічних електродів другого роду, складіть загальну
- •46.)Визначіть склад газових (водневого та кисневого) електордів, складіть
- •49.)Вкажіть склад комбінованого гальванічного елементу ,анодний та катодний
- •50.)Поясніть, чому напруга гальванічного елемента відрізняється від
- •51. )Дайте характеристику поляризації гальванічного елемента.
- •52.) Дайте характеристику та класифікацію корозійних процесів.
- •53.)Визначіть причини гальванокорозіі та способи захисту від корозії .
- •54. ) Вкажіть склад корозійного гальванічного елементу, рівняння анодного і
- •55.)Опишіть принцип роботи електрохімічних батарейок ,склад електрохімічної
- •56.)Поясніть принцип роботи свинцевого акумулятора ,наведіть рівняння
- •57.)Поясніть принцип роботи паливних елементів , наведіть рівняння анодного і
- •58.)Визначіть анодні та катодні процеси під час атмосферної корозії сталі.
- •60.)Визначіть закономірності процесів відновлення та окиснення частинок під час електролізу.
57.)Поясніть принцип роботи паливних елементів , наведіть рівняння анодного і
катодного процесів . Наведіть приклади .
Паливний елемент — електрохімічний генератор, який забезпечує пряме перетворення хімічної енергії на електричну. Паливний елемент, найважливіша складова частина електрохімічного генератора, що забезпечує пряме перетворення хімічної енергії (реагентів — палива і окислювача) в електричну. Основу Т. е. складають два електроди, розділені твердим або рідким електролітом (див. мал.(малюнок)). Паливо і окислювач подаються в порожнини, що граничать з електродами; на поверхні розділу електроліт — електрод у присутності каталізатора відбуваються реакції окислення і відновлення (див. Окислення-відновлення ). В результаті цих реакцій утворюються іони А — і В + (що рекомбінують потім до кінцевого продукту реакції AB ) і виділяється (або поглинається) тепло Q. Палива, що звільнилися при реакції окислення електрони створюють на відповідному електроді (аноді) надлишковий негативний заряд; на катоді в результаті реакції відновлення окислювача створюється надлишковий позитивний заряд. При замиканні зовнішнього ланцюга в ній з'являється електричний струм, що здійснює корисну роботу Е пів . Сумарна реакція: А + У = AB + Q+ Е пів . Електроліт в Т. е. не лише містить речовини, що беруть участь в електрохімічних реакціях, але і забезпечує просторове розділення процесів окислення і відновлення. Для ефективної роботи Т. е. необхідні розвинена поверхня електродів (до сотень м 2 на г речовини), раціональна організація процесів адсорбції і іонізації молекул реагуючих речовин і відведення електронів і продуктів реакції, висока чистота реагентів. У разі водень-кисневого паливного елемента електрохімічну реакцію, що протікає на аноді, відображає рівняння:
![]()
відповідно, катодний процес може бути представлений у вигляді:
![]()
58.)Визначіть анодні та катодні процеси під час атмосферної корозії сталі.
Атмосферна корозія сталі – це процес іржавіння заліза.Іржавіння заліза - це електрохімічний процес, який починається з перенесення електронів від заліза до кисню.[3] Швидкість корозії залежить від кількості наявної води, і прискорюється електролітами, про що свідчать наслідки застосування дорожньої солі на корозію автомобілів. Ключовою реакцією є відновлення кисню:O2 + 4 e− + 2 H2O → 4 OH−Оскільки при цьому утворюються йони гідроксидів, цей процес сильно залежить від присутності кислоти. Дійсно, корозія більшості металів киснем прискорюється при зниженні рН. Забезпечення електронів для вищенаведеної реакції відбувається при окисненні заліза, яке може бути описане наступним чином:Fe → Fe2+ + 2 e−
Наступна окиснювально-відновна реакція відбувається в присутності води і має вирішальне значення для формування іржі:
4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Крім того, такі багатоступінчасті кислотно-лужні реакції впливають на хід формування іржі:
F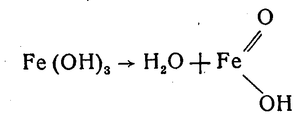 e3+ +
3 H2O ⇌ Fe(OH)3 +
3 H+
e3+ +
3 H2O ⇌ Fe(OH)3 +
3 H+
що призводить до таких реакцій підтримки балансу дегідратації:
Fe(OH)2 ⇌ FeO + H2O
Fe(OH)3 ⇌ FeO(OH) + H2O
FeO(OH) ⇌ Fe2O3 + H2O
59.)Дайте характеристику процесам електролізу та наведіть приклади їх застосування в промисловості.Електроліз - це сукупність процесів електрохімічного окислення - відновлення, що відбуваються на занурених в електроліт електродах при проходженні електричного струму. Застосовується для одержання багатьох речовин (металів, водню, хлору та ін), При нанесенні металевих покриттів (гальваностегія), відтворенні форми предметів (гальванопластика) Електрохімічні процеси широко застосовуються в різних областях сучасної техніки, в аналітичної хімії, біохімії і т. д. У хімічній промисловості електролізом одержують хлор і фтор, луги, хлорати й перхлорати, надсерную кислоту і персульфати, хімічно чисті водень і кисень і т. д. При цьому одні речовини одержують шляхом відновлення на катоді (альдегіди, параамінофенола та ін), Інші електроокислення на аноді (хлорати, перхлорати, перманганат калію та ін.) Гальванотехніка – галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їх солей. Гальванотехніка ділиться на гальваностегію і гальванопластики. Гальваностегія (від грец покривати.) - Це електроосадження на поверхню металу іншого металу, який міцно зв'язується (зчіплюється) з вкриває металом (предметом), службовцям катодом електролізера.
