
- •Законы Ньютона. 1-ый закон. Инерция. Инерциальные и неинерциальные со. Импульс тела. 2-ой закон. 3-й закон. Пределы применимости законов Ньютона.
- •Механическая система. Замкнутая система. Вывод закона сохранения импульса замкнутой системы тел.
- •Потенциальная энергия, напряженность поля тяготения. Зависимость напряженности поля тяготения от высоты. Потенциальная энергия упруго сжатой пружины.
- •Вывод закона сохранения механической энергии и теоремы об изменении полной механической энергии системы. Абсолютно упругий и неупругий удар.
- •Теорема Штейнера. Кинетическая энергия тела, вращающегося вокруг неподвижной оси. Кинетическая энергия плоского движения.
- •Момент силы относительно полюса, оси. Работа при вращательном движении. Вывод основное уравнение динамики вращательного движения атт.
- •Вязкость. Ламинарный и турбулентный режимы течения жидкости. Число Рейнольдса. Методы определения вязкости (метод Стока и Пуазейля).
- •Метод Стокса (вывод).
- •Явление переноса
- •Теплопроводность
- •Диффузия.
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Уравнение Фурье
- •Молекулярно-кинетическая теория идеальных газов. Понятие идеального газа.Законы Бойля-Мариотта, Гей-люссака, Авогадро и Дальтона. Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ.
- •Закон Бойля-Мариотта.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Закон Авогадро.
- •Барометрическая формула. Распределение Больцмана. Распределение Больцмана
- •Термодинамические параметры
- •Термодинамические процессы
- •Первое начало термодинамики
- •Степени свободы в статистической физике и термодинамике
- •Закон Больцмана о равномерном распределении энергии по степеням свободы молекул:
- •Теплоемкость удельная и молярная. Вывод уравнения Майера. Коэффициент Пуассона. Экспериментальная зависимость теплоемкости газа от температуры.
- •Молярная теплоёмкость
- •Уравнение Майера
- •Коэффициент Пуассона
- •Применение первого начала термодинамики к расчету изопроцессов. Изохорный, изобарный, изотермический и адиабатический процессы.
- •Адиабатный процесс. Вывод уравнения Пуассона для адиабатного процесса.
- •Круговые процессы. Прямой и обратный цикл. Тепловой двигатель и холодильная машина. Термический коэффициент полезного действия. Обратимые и необратимые процессы.
- •Цикл Карно. Диаграмма. Вывод к.П.Д. Цикла Карно.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнения Ван-дер-Ваальса. Анализ изотерм Ван-дер-Ваальса. Сжижение газов.
- •Фазовые переходы. Фазовые переходы 1 и 2-го рода. Уравнение Клапейрона-Клаузиуса. Диаграмма состояний. Тройная точка.
- •Статистическое толкование энтропии. Микро- и макросостояние системы. Термодинамическая вероятность. Формула Больцмана.
Барометрическая формула. Распределение Больцмана. Распределение Больцмана
Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871.
Согласно распределению
Больцмана среднее
число частиц с полной энергией ![]() равно
равно
![]()
где ![]() —
кратность состояния частицы с энергией
—
число возможных состояний частицы с
энергией
.
Постоянная
—
кратность состояния частицы с энергией
—
число возможных состояний частицы с
энергией
.
Постоянная ![]() находится
из условия, что сумма
находится
из условия, что сумма ![]() по
всем возможным значениям
по
всем возможным значениям ![]() равна
заданному полному числу частиц
равна
заданному полному числу частиц ![]() в
системе (условие нормировки):
в
системе (условие нормировки):
![]()
В случае, когда движение частиц подчиняется классической механике, энергию можно считать состоящей из
кинетической энергии
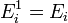 (кин)
частицы (молекулы или атома),
(кин)
частицы (молекулы или атома),внутренней энергии
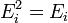 (вн)
(например, энергии возбуждения электронов)
и
(вн)
(например, энергии возбуждения электронов)
ипотенциальной энергии
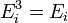 (пот)
во внешнем поле, зависящей от положения
частицы в пространстве:
(пот)
во внешнем поле, зависящей от положения
частицы в пространстве:
![]()
Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести.
Для идеального
газа,
имеющего постоянную температуру
и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения ![]() одинаково),
барометрическая формула имеет следующий
вид:
одинаково),
барометрическая формула имеет следующий
вид:

где
—
давление газа в слое, расположенном на
высоте ![]() ,
, ![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
), ![]() — молярная
масса газа,
— универсальная
газовая постоянная,
—абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул
— молярная
масса газа,
— универсальная
газовая постоянная,
—абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул ![]() (или
плотность газа) убывает с высотой по
тому же закону:
(или
плотность газа) убывает с высотой по
тому же закону:
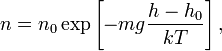
где ![]() —
масса молекулы газа,
—
масса молекулы газа, ![]() — постоянная
Больцмана.
— постоянная
Больцмана.
Введение в термодинамику. Термодинамическая система, процесс, параметры. Число степеней свободы. Закон Больцмана о равнораспределении энергии по степеням свободы молекулы. Первое начало термодинамики. Работа газа при изменении объема.
Термодинамические системы
В термодинамике изучаются физические системы, состоящие из большого числа частиц и находящиеся в состоянии термодинамического равновесия или близком к нему. Такие системы называются термодинамическими системами. Это понятие в общем случае достаточно сложно определить строго, поэтому используется описательное определение, в котором термодинамической системой называется макроскопическая система, которая каким-то образом (например, с помощью реальной или воображаемой оболочки) выделена из окружающей среды и способна взаимодействовать с ней. Если оболочка не допускает обмен ни веществом, ни энергией между системой и окружающей средой, то такая оболочка называется адиабатической, а соответствующая система - изолированной или замкнутой. Системы, у которых оболочка не препятствует обмену веществом и энергией, называются открытыми.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числамакроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами. Если параметр имеет одно и то же значение, не зависящее от размера любой выделенной части равновесной системы, то он называется неаддитивным или интенсивным, если же значение параметра пропорционально размеру части системы, то он называется аддитивным или экстенсивным[9]. Давление и температура — неаддитивные параметры, а внутренняя энергия и энтропия — аддитивные параметры.
Макроскопические параметры могут подразделяться на внутренние, характеризующие состояние системы как таковой, и внешние, описывающие взаимодействие системы с окружающей средой и силовыми полями, воздействующими на систему, однако это разделение достаточно условно. Так, если газ заключен в сосуд с подвижными стенками и его объём определяется положением стенок, то объём является внешним параметром, а давление газа зависит от скоростей теплового движения молекул и является внутренним параметром. Напротив, если задаётся внешнее давление, то его можно считать внешним параметром, а объём газа — внутренним параметром. Постулируется, что в состоянии термодинамического равновесия каждый внутренний параметр может быть выражен через внешние параметры и температуру системы. Такая функциональная связь называется обобщённым уравнением состояния системы[10].
