
- •Законы Ньютона. 1-ый закон. Инерция. Инерциальные и неинерциальные со. Импульс тела. 2-ой закон. 3-й закон. Пределы применимости законов Ньютона.
- •Механическая система. Замкнутая система. Вывод закона сохранения импульса замкнутой системы тел.
- •Потенциальная энергия, напряженность поля тяготения. Зависимость напряженности поля тяготения от высоты. Потенциальная энергия упруго сжатой пружины.
- •Вывод закона сохранения механической энергии и теоремы об изменении полной механической энергии системы. Абсолютно упругий и неупругий удар.
- •Теорема Штейнера. Кинетическая энергия тела, вращающегося вокруг неподвижной оси. Кинетическая энергия плоского движения.
- •Момент силы относительно полюса, оси. Работа при вращательном движении. Вывод основное уравнение динамики вращательного движения атт.
- •Вязкость. Ламинарный и турбулентный режимы течения жидкости. Число Рейнольдса. Методы определения вязкости (метод Стока и Пуазейля).
- •Метод Стокса (вывод).
- •Явление переноса
- •Теплопроводность
- •Диффузия.
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Уравнение Фурье
- •Молекулярно-кинетическая теория идеальных газов. Понятие идеального газа.Законы Бойля-Мариотта, Гей-люссака, Авогадро и Дальтона. Молекулярно-кинетическая теория идеальных газов
- •Идеальный газ.
- •Закон Бойля-Мариотта.
- •Закон Дальтона.
- •Закон Гей-Люссака.
- •Закон Авогадро.
- •Барометрическая формула. Распределение Больцмана. Распределение Больцмана
- •Термодинамические параметры
- •Термодинамические процессы
- •Первое начало термодинамики
- •Степени свободы в статистической физике и термодинамике
- •Закон Больцмана о равномерном распределении энергии по степеням свободы молекул:
- •Теплоемкость удельная и молярная. Вывод уравнения Майера. Коэффициент Пуассона. Экспериментальная зависимость теплоемкости газа от температуры.
- •Молярная теплоёмкость
- •Уравнение Майера
- •Коэффициент Пуассона
- •Применение первого начала термодинамики к расчету изопроцессов. Изохорный, изобарный, изотермический и адиабатический процессы.
- •Адиабатный процесс. Вывод уравнения Пуассона для адиабатного процесса.
- •Круговые процессы. Прямой и обратный цикл. Тепловой двигатель и холодильная машина. Термический коэффициент полезного действия. Обратимые и необратимые процессы.
- •Цикл Карно. Диаграмма. Вывод к.П.Д. Цикла Карно.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнения Ван-дер-Ваальса. Анализ изотерм Ван-дер-Ваальса. Сжижение газов.
- •Фазовые переходы. Фазовые переходы 1 и 2-го рода. Уравнение Клапейрона-Клаузиуса. Диаграмма состояний. Тройная точка.
- •Статистическое толкование энтропии. Микро- и макросостояние системы. Термодинамическая вероятность. Формула Больцмана.
Среднее число столкновений и средняя длина свободного пробега молекул
средняя
длина свободного пробега ![]() -
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
-
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
движущаяся
со средней скоростью молекула в течении
одной секунды столкнется со всеми
молекулами, центры которых находятся
в объеме ограниченном цилиндром с
радиусом 2r и длиной ![]() ,
т.е.
,
т.е.
![]() .
.
Если концентрация молекул n , то внутри рассмотренного цилиндра находится число молекул, равное
![]()
Это число ![]() и
определяет среднее число соударений
за единицу времени.
и
определяет среднее число соударений
за единицу времени.
В действительности все молекулы движутся, и возможность соударения двух частиц зависит от их относительной скорости.
Средний
путь, проходимый молекулой за единицу
времени, численно равен
.
Поэтому средняя длина свободного пробега
равна ![]() или
или
|
средняя длина свободного пробега не зависит от температуры газа, т.к. с ростом температуры одновременно возрастают и , и .
Среднее
расстояние между центрами молекул,
взаимодействующих, как при упругом
ударе, называют эффективным
диаметром ![]() .
.
![]()
Уравнение Фурье
Уравнение теплопроводности — важное уравнение в частных производных, которое описывает распространение тепла в заданной области пространства во времени.
Для функции u(x,y,z,t) трёх пространственных переменных (x,y,z) и времени t, уравнение теплопроводности имеет вид
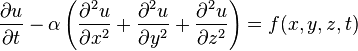 ,
,
где ![]() —
функция тепловых источников.
—
функция тепловых источников.
Для произвольной системы координат:
где α — положительная константа, а Δ или ∇2 — оператор Лапласа.
Молекулярно-кинетическая теория идеальных газов. Понятие идеального газа.Законы Бойля-Мариотта, Гей-люссака, Авогадро и Дальтона. Молекулярно-кинетическая теория идеальных газов
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ.
|
расстояния между молекулами велики по сравнению с их размерами; |
|
взаимодействие между молекулами на расстоянии отсутствует; |
|
при столкновениях молекул действуют большие силы отталкивания; |
|
время столкновения много меньше времени свободного движения между столкновениями. |
![]() ,
(11)
где n
,
(11)
где n ![]() –концентрация
молекул.
–концентрация
молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Авогадро вывел закон, что в равных объемах газа содержится одинаковое коли-
чество молекул. Учитывая, что в одном моле газа содержится NA молекул, мо-
жем получить связь между постоянной Больцмана и универсальной газовой по-
стоянной:
R A = kN
