
- •2.3 Планы лабораторных занятий
- •1. Лабораторная работа №1. Классы неорганических соединений.
- •2 Лабораторная работа №2. Определение эквивалентной массы цинка методом вытеснения водорода.
- •3. Лабораторная работа №3 (1). Скорость химической реакции. Зависимость от концентраций и температуры.
- •3. Лабораторная работа №3(2). Смещение равновесия обратимой реакции между хлоридом железа (III) и роданидом калия.
- •(A)Проведение опыта
- •Запись данных опыта
- •4. Лабораторная работа №4. Электролитическая диссоциация и ионные процессы.
- •5. Лабораторная работа №5. Гидролиз солей. Влияние температуры и разбавления раствора на степень гидролиза.
- •6. Лабораторная работа №6. Окислительно-восстановительные процессы.
- •7. Лабораторная работа №7. Ряд напряжений металлов и гальванический элемент. Электролиз растворов солей.
- •(B)Опыт 1. Электролиз сульфата меди
- •(C)Опыт 2. Электролиз йодида калия
- •8. Лабораторная работа №8. Комплексные соединения.
- •Образование соединений с комплекным анионом
- •Образование соединений с комплексным катионом
- •2.4 Планы практических занятий
- •2.4 Планы практических занятий
- •2.5. Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя (срсп).
- •2.6 План занятий в рамках самостоятельной работы студентов (срс).
- •2.7 Тестовые задания для самоконтроля:
- •2.8 Экзаменационные вопросы по курсу
7. Лабораторная работа №7. Ряд напряжений металлов и гальванический элемент. Электролиз растворов солей.
Задание:
1. Изучить электролиз водного раствора соли на индеферентных электродах.
2. Изучить электролиз расплава соли.
3. Изучить электролиз с растворимым анодом.
Окислительно-восстановительный процесс, протекающий при прохождении электрического тока через раствор или расплав электролита, называется электролизом.
Прибор для электролиза представляет собой U – образный сосуд с раствором электролита, в который погружено два электрода – растворимые или нерастворимые. Один из них подключен к положительному полюсу внешнего источника тока, а другой – отрицательному полюсу.
В зависимости от природы электролита и материала электрода различают три типа электролиза:
электролиз водного раствора соли на индеферентных электродах;
электролиз расплава соли;
электролиз с растворимым анодом, т.е. очистка металлов.
Рассмотрим как протекает электролиз водного раствора NaCl на графитовых электродах.
При электролизе водного раствора NaCl на катоде восстанавливаются ионы водорода, а на аноде происходит окисление ОН- или Н2О с образованием кислорода. Схема электролиза водного раствора NaCl выглядит так:
Катод NaCl Анод
- НОН +
Na+, Н+ Cl-, ОН- или Н2О
2Н2О + 2е = Н2 + 2ОН- 2Н2О - 4е = О2 + 4Н+

2Н2О = 2Н2↑ + О2↑
В прикатодном пространстве образуется NaОН, а около анода – НCl.
Рассмотрим электролиз расплава NaCl. При электролизе расплава хлорида натрия на катоде восстанавливается натрий, а на аноде окисляется хлор. Схема электролиза расплава NaCl выглядит так:
Катод NaCl = Na+ + Cl- Анод
- +
Na+ Cl-
Na+ + е = Na0 2Cl- - 2е = Cl 2 + 4Н+
2 Na+ + 2Cl- = 2Na0 + Cl2
(B)Опыт 1. Электролиз сульфата меди
Налейте в электролизер раствор сульфата меди. Опустите в него графитовые электроды и пропустите через раствор электрический ток; опыт проводите несколько минут. Что наблюда-ется на катоде? Напишите уравнения катодного и анодного процессов. Какой газ выделяется на аноде?
(C)Опыт 2. Электролиз йодида калия
Н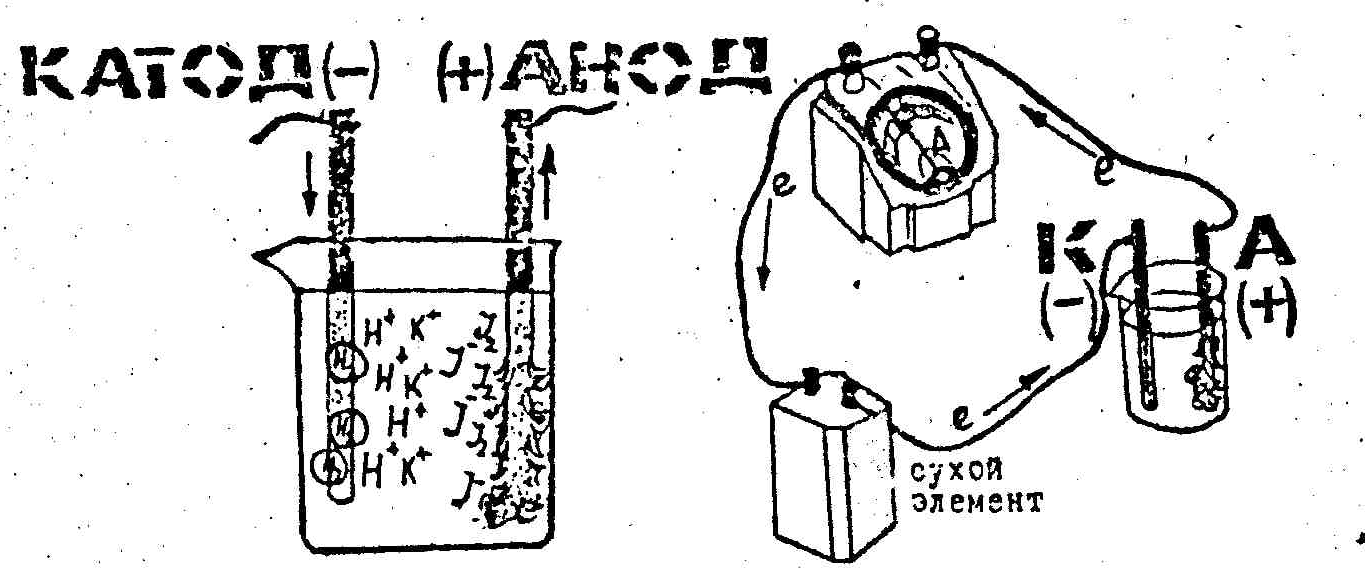 алейте
в пробирку на ¾ ее объема 0,1Н раствора
KJ и добавьте по 5-6 капель
фенолфталеина и крахмального клейстера.
Перемешайте раствор и перелейте в
электролизер. Опустите в электролизер
графитовые электроды и подключите их
к источнику тока (рис.2).
алейте
в пробирку на ¾ ее объема 0,1Н раствора
KJ и добавьте по 5-6 капель
фенолфталеина и крахмального клейстера.
Перемешайте раствор и перелейте в
электролизер. Опустите в электролизер
графитовые электроды и подключите их
к источнику тока (рис.2).
Рис.2 Схема процесса электролиза
Почему на катоде не выделяется металлический калий? Сравните нормальные окислительно-восстановительные потенциалы калия, водорода, йода и кислорода. Появлением каких ионов в процессе электролиза обусловлено окрашивание в красный цвет раствора в катодном пространстве?
Напишите уравнение анодного и катодного процессов. Чем обусловлено посинение раствора в анодном пространстве?
Количественная характеристика электролиза варажается законом Фарадея: m = γΙt / 96500, где m – масса выделившегося вещества, г
Ι – сила тока в А;
T – время в секундах;
96500 – число Фарадея.
Основная литература:
[6], стр. 65 - 67.
[7], стр.89-90, 94-95.
Контрольные вопросы:
1. При электролизе раствора хлорида кальция на катоде выделилось 5,6г водорода. Какой газ и какой массой выделился на аноде?
2. Вычислите массу свинца, выделившегося на катоде в результате пропускания тока силой в 3А через расплавленный бромид свинца (ΙΙ) в течение 30 минут.
3. Практикум по неорганической химии/ Гольбрайх З.Е. - М: Высшая школа, 1986. –338с.
