
- •2.3 Планы лабораторных занятий
- •1. Лабораторная работа №1. Классы неорганических соединений.
- •2 Лабораторная работа №2. Определение эквивалентной массы цинка методом вытеснения водорода.
- •3. Лабораторная работа №3 (1). Скорость химической реакции. Зависимость от концентраций и температуры.
- •3. Лабораторная работа №3(2). Смещение равновесия обратимой реакции между хлоридом железа (III) и роданидом калия.
- •(A)Проведение опыта
- •Запись данных опыта
- •4. Лабораторная работа №4. Электролитическая диссоциация и ионные процессы.
- •5. Лабораторная работа №5. Гидролиз солей. Влияние температуры и разбавления раствора на степень гидролиза.
- •6. Лабораторная работа №6. Окислительно-восстановительные процессы.
- •7. Лабораторная работа №7. Ряд напряжений металлов и гальванический элемент. Электролиз растворов солей.
- •(B)Опыт 1. Электролиз сульфата меди
- •(C)Опыт 2. Электролиз йодида калия
- •8. Лабораторная работа №8. Комплексные соединения.
- •Образование соединений с комплекным анионом
- •Образование соединений с комплексным катионом
- •2.4 Планы практических занятий
- •2.4 Планы практических занятий
- •2.5. Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя (срсп).
- •2.6 План занятий в рамках самостоятельной работы студентов (срс).
- •2.7 Тестовые задания для самоконтроля:
- •2.8 Экзаменационные вопросы по курсу
Тема лекции 1: Введение. Предмет химии. Основные классы неорганических соединений. (2 часа).
Материя проявляется в двух формах – вещества и поля. Вещество – одна из основных форм существования материи, состоящая из частиц, имеющих собственную массу, массу покоя. Например, молекул, атомов, электронов, атомных ядер. Поле – это такая форма существования материи, которая характеризуется, прежде всего, энергией. Посредством поля осуществляется связь и взаимодействие между частицами вещества.
В настоящее время известно около 6 млн. различных природных и искусственно полученных веществ.
Неотъемлемым свойством материи, ее атрибутом является движение. Материя находится в непрерывном движении, она неразрывно связана с движением. Формы движения материи очень разнообразны, они взаимосвязаны, могут переходить одна в другую. Например, механическая в электрическую, электрическая в тепловую и т. д.
Простейшим носителем химической формы движения материи является атом. При химических процессах происходит обмен атомами между различными веществами, разрушение одних веществ и возникновение других, т. е. в результате химических процессов возникают новые вещества с другими физическими и химическими свойствами. Следовательно, химическое изменение обязательно сопровождается появлением новых химических индивидов.
Химия – наука о веществах и их превращениях, сопровождающихся перераспределением химических связей между атомами, как входящими в состав химических частиц, так и свободными.
Химия изучает состав, строение, свойства веществ и их превращения.
Как одна из отраслей естествознания химия связана с другими науками (геохимия, физ. химия, космохимия и др.).
Предметом изучения нашего курса является химия. Это – основные понятия и законы химии, общие закономерности протекания химических реакций, теория химической связи, учение о растворах и другие основополагающие концепции химии.
Велико значение химии в технике, развитие которой немыслимо без понимания процессов превращения веществ. Применение законов химии позволяет совершенствовать существующие и создавать новые процессы, технологии и материалы.
Химические реакции широко применяются во многих производственных процессах. Например, процессы окисления-восстановления в металлургии, получение металлов, топлива, электроэнергии, синтетических материалов, продуктов питания непосредственно связаны с химическими реакциями. Для развития новой техники и технологий необходимы материалы с особыми заданными свойствами – сверхтвердые, жаростойкие, сверхчистые, устойчивые к коррозии. Такие материалы позволяет получить химическая промышленность. Все вышесказанное подтверждает необходимость изучения химии для инженера любой специальности, а дисциплины неорганическая химия – инженера химико-технологической специальности.
Основные классы неорганических соединений:
Оксиды
Кислоты
Основания (Гидроксиды).
Соли: средние (нормальные), кислые (гидросоли), основные (гидроксосоли).
Кислоты. Классификация кислот. Химические свойства.
Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.
Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение: Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
H2SO4 |
+ |
Mg |
= |
MgSO4 |
+ |
H2 |
серная кислота |
|
металл |
|
соль |
|
водород |
H2SO4 |
+ |
MgO |
= |
MgSO4 |
+ |
H2O |
серная кислота |
|
оксид |
|
соль |
|
вода |
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
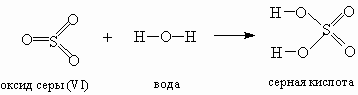


Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4. Одно "рождается" из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль). Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода. По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1).
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот. Об индикаторах мы более подробно расскажем в следующем параграфе на примере их реакций с основаниями.
2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
кислота |
|
основание |
|
соль |
|
вода |
H2SO4 |
+ |
Ca(OH)2 |
= |
CaSO4 |
+ |
2H2O |
H3PO4 |
+ |
Fe(OH)3 |
= |
FePO4 |
+ |
3H2O |
2 H3PO4 |
+ |
3 Ca(OH)2 |
= |
Ca3(PO4)2 |
+ |
6H2O |
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
кислота |
|
оксид |
|
соль |
|
вода |
2 HCl |
+ |
CaO |
= |
CaCl2 |
+ |
H2O |
2H3PO4 |
+ |
Fe2O3 |
= |
2 FePO4 |
+ |
3H2O |
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, ртуть и некоторые другие металлы с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
кислота |
|
металл |
|
соль |
|
|
HCl |
+ |
Hg |
= |
не образуется |
|
|
2 HCl |
|
2 Na |
= |
2 NaCl |
+ |
H2 |
H2SO4 |
+ |
Zn |
= |
ZnSO4 |
+ |
H2 |
В связи с этим существует еще одна классификация кислот – по силе. В таблице 8-4 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 8-4. Классификация кислот на сильные и слабые кислоты.
Сильные кислоты |
Слабые кислоты |
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная |
HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Основания. Свойства и классификация оснований. Щелочи..
Если вещество содержит гидрокси-группы (ОН), которые могут отщепляться (подобно отдельному "атому") в реакциях с другими веществами, то такое вещество является основанием. Существует много оснований, которые состоят из атома какого-либо металла и присоединенных к нему гидрокси-групп. Например:
NaOH – гидроксид натрия,
Ca(OH)2 – гидроксид кальция,
Fe(OH)3 – гидроксид железа (III),
Гидрокси-группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований – ионные соединения.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH.
Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 + H2O = NH4OH (гидроксид аммония).
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.
Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, уксусной). Этот способ медицинской помощи основан на уже известной нам реакции нейтрализации.
NaOH + уксусная кислота (разб.) = соль + вода
Щелочи составляют лишь небольшую часть всех оснований. Это NaOH – гидроксид калия (едкое кали), KOH – гидроксид натрия (едкий натр), Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария и некоторые другие.
Большинство оснований в воде нерастворимы. Это, например, Cu(OH)2 – гидроксид меди (II), Fe(OH)3 – гидроксид железа (III) и многие другие. Такие основания щелочами не называют.
Щелочами называются растворимые в воде сильные основания.
Химические свойства оснований связаны с их способностью отдавать другим соединениям гидрокси-группу.
Рассмотрим еще раз типичные реакции нейтрализации между щелочью и кислотой при помощи структурных формул:

Пунктирными линиями показаны наиболее слабые химические связи в основании и кислоте, которые разрываются в реакциях нейтрализации. Такая схема наглядно показывает различие между кислотами и основаниями: кислоты склонны отщеплять атомы водорода, а основания – гидроксигруппы.
В реакцию нейтрализации с кислотами легко вступают все основания, а не только щелочи.
Растворы щелочей окрашивают индикаторы: лакмус – в синий цвет, фенолфталеин – в малиновый цвет. Индикатор метиловый оранжевый (или метилоранж) в растворах щелочей имеет желтый цвет
Химические свойства оксидов |
|
Основных |
Кислотных |
CuO + H2SO4 = CuSO4 + H2O 2. Оксиды активных металлов взаимодействуют с водой с образованием щелочи: Li2O +H2O=2LiOH |
СO2 + Ca(OH)2= CaCO3 + H2O
P2O5 + 3H2O = 2H3PO4
|
3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли: Ca O + CO2 = CaCO3 |
|
4. Менее летучие кислотные оксиды вытесняют более летучие из их солей: Сa CO3 + SiO3 = CaSiO3 + CO2 |
|
Основная литература: [1] – стр.10-14; [2] – стр. 4; [3] – стр. 5-11; [4] – с. 9-16.
Дополнительная литература: [6] – стр. 9-12, [12] – стр. 7-11, [13] – стр. 4-6, [23] – стр. 6 – 29, [24] – стр. 11-14.
Контрольные вопросы:
Какая форма материи называется веществом?
Что означает химическая форма движения материи?
Что изучает химия?
Что изучает неорганическая химия?
Значение химии в технике и технологиях.
Тема лекции 2: Основные понятия и законы химии. Элемент, атом, молекула, молекулярная масса, моль, эквивалент. Законы: сохранения энергии, постоянства состава, кратных отношений, объёмных отношений, эквивалентов и закон Авогадро (2 часа).
1. Атомно-молекулярная теория, созданная М.В. Ломоносовым в 1748 г. является основой научной химии:
все вещества состоят из элементов (атомы) и корпускул (молекулы);
которые находятся в непрерывном движении.
Таким образом объясняется и природа теплоты.
2. Понятия масса и вес.
Масса – свойство тела или вещества, характеризующее их инерционность или способность создавать гравитационное поле. Обозначается символом m. Единица измерения в СИ – кг, г.
Вес – это сила, возникающая вследствие взаимодействия тела с гравитационным полем и зависит от ускорения свободного падения h=mg.
Масса тела может быть взвешена на весах (рычажных, пружинных), вес тела – динамометром. В химии используется понятие масса.
3. Атомная единица массы. Относительные атомные и молекулярные массы.
Абсолютные массы атомов и молекул чрезвычайно малы:
mа(Н)=1,674*10-24г,
mа(С)=1,993*10-23г,
mм(Н2О)=2,99*10-23г.
П![]() ользоваться
такими величинами неудобно. С 1961г за
а.е.м. принята 1/12 часть массы атома
изотопа углерода 12 она равна 1,66*10-24г,
отсюда
ользоваться
такими величинами неудобно. С 1961г за
а.е.м. принята 1/12 часть массы атома
изотопа углерода 12 она равна 1,66*10-24г,
отсюда
где Ar(H) – относительная атомная масса водорода, которая показывает во сколько раз атом водорода тяжелее а.е.м., безразмерная величина.
![]() Мr(Н2О)
– относительная молекулярная масса
воды равна:
Мr(Н2О)
– относительная молекулярная масса
воды равна:
Относительную молекулярную массу воды можно посчитать и как сумму относительных атомных масс водорода и кислорода.
Мr(Н2О)=2*1,0079+15,999=18,015
4. Моль. Молярная масса. Постоянная Авогадро. В СИ моль – единица количества вещества, обозначают: ν(Са)=1,2 моль, ν(NаOH)=3 моль.
Молем называется количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов), сколько атомов содержится в 12 г изотопа углерода 12С.
У![]() становлено,
что в 12 г содержится 6,02*1023
структурных единиц – постоянная
Авогадро.
становлено,
что в 12 г содержится 6,02*1023
структурных единиц – постоянная
Авогадро.
Молярная масса М – масса моля вещества имеет размерность г/моль. Так М(NaOH)=40 г/моль. Числовое значение молярной массы совпадает с относительной молекулярной массой.
М![]() =Мr
=Мr
К![]() оличество
вещества и молярная масса связаны с
массой соотношением:
оличество
вещества и молярная масса связаны с
массой соотношением:
М![]() олекулярную
массу вещества можно вычислить зная
массу молекулы. Так
олекулярную
массу вещества можно вычислить зная
массу молекулы. Так
М(Н2О)=2,99*10-23г*6,02*1023моль-1=18г/моль
Числовые значения массы отдельных атомов и молекул можно найти используя а.е.м. или же постоянную Авогадро
m![]() a(Fe)=1.66*10-24г*56=9,29*10-23г
a(Fe)=1.66*10-24г*56=9,29*10-23г
5. Основные законы химии. Закон сохранения массы и энергии сформулировал М. В. Ломоносов в 1748 году. Масса веществ участвующих в химических реакциях не изменяется. В 1905г Эйнштейн полагал, взаимосвязь между энергией и массой
Е![]() =m*c2
=m*c2
с=3*108м/с
Масса и энергия есть свойства материи. Масса – мера энергии. Энергия – мера движения, поэтому они не эквивалентны и не превращаются друг в друга, однако всякий раз, когда изменяется энергия тела Е, изменяется его масса m. Ощутимые изменения массы происходят в ядерной химии.
С точки зрения атомно-молекулярной теории атомы имеющие постоянную массу не исчезают и не возникают из ничего, это приводит к сохранению массы веществ. Закон доказан экспериментально. Опираясь на этот закон составляются химические уравнения. Количественные расчеты по уравнениям реакций называют стехиометрическими расчетами. В основе всех количественных расчетов лежит закон сохранения массы, и следовательно, можно планировать и контролировать производство.
6. Закон постоянства состава сформулирован французским ученым Прустом в 1808г. Всякое чистое вещество независимо от способов его получения, всегда имеет постоянный качественный и количественный состав, если в данном агрегатном состоянии имеет молекулярную структуру. В воде по массе содержится 4,19% водорода и 88,81% кислорода – это количественный состав, из элементов - Н и О – качественный состав.
Дальтониды – вещества с постоянным составом и целочисленными коэффициентами:H2O, HCl, CH4, C6H6.
Бертолиды – вещества переменного состава с дробными индексами TiO0.7-TiO1.3. К ним относятся оксиды, гидриды, сульфиды, карбиды и др.
7. Закон кратных отношений сформулирован английским ученым Дальтоном в 1803г, справедлив для газообразных и парообразных соединений. Состав дальтонидов меняется скачкообразно, т.к. в реакцию вступают целые числа атомов, с другой стороны количество переходит в качество по выражению Ф. Энгельса это и есть всеобщий закон развития природы, общества и мышления и следовательно химия наука о качественных изменениях тел, происходящих под влиянием изменений количественного состава.
8. Закон эквивалентов открыт Рихтером в 1791 г. Атомы элементов взаимодействуют друг с другом в строго определенных соотношениях – эквивалентах.
В![]() СИ эквивалент есть 1/z часть (воображаемая)
частицы Х. Х – атом, молекула, ион и т.д.
Z – равен числу протонов, которое
связывает или отдает частица Х (эквивалент
нейтрализации) или числу электронов,
которое отдает или принимает частица
Х (эквивалент окисления-восстановления)
или заряду иона Х (ионный эквивалент).
СИ эквивалент есть 1/z часть (воображаемая)
частицы Х. Х – атом, молекула, ион и т.д.
Z – равен числу протонов, которое
связывает или отдает частица Х (эквивалент
нейтрализации) или числу электронов,
которое отдает или принимает частица
Х (эквивалент окисления-восстановления)
или заряду иона Х (ионный эквивалент).
Молярная масса эквивалента, размерность – г/моль, есть отношение молярной массы частицы Х к числу Z.
![]()
Например: Молярная масса эквивалента элемента определяется отношением молярной массы элемента к его валентности.
в![]() Н2О
Н2О
в![]() Аl2O3
Аl2O3
Закон эквивалентов:
Массы реагирующих веществ относятся между собой, как молярные массы их эквивалентов.
М атематическое
выражение
атематическое
выражение
где m1 и m2 – массы реагирующих веществ,
-![]() молярные массы их эквивалентов.
молярные массы их эквивалентов.
Е![]()
![]()
 сли
реагирующая порция вещества характеризуется
не массой, а объемом V(x), то в выражении
закона эквивалентов его молярная масса
эквивалента заменяется молярным объемом
эквивалента.
сли
реагирующая порция вещества характеризуется
не массой, а объемом V(x), то в выражении
закона эквивалентов его молярная масса
эквивалента заменяется молярным объемом
эквивалента.
9![]()
![]() .
Законы газообразного
состояния вещества
.
Законы газообразного
состояния вещества
Объем газа зависит от природы газа, массы и условий, при которых он находится, - температуры и давления.
П![]() о
закону Гей-Люссака: при
постоянном давлении (Р=const) объем данной
массы газа прямо пропорционален
абсолютной температуре
о
закону Гей-Люссака: при
постоянном давлении (Р=const) объем данной
массы газа прямо пропорционален
абсолютной температуре
По закону Бойля-Мариотта: при постоянной температуре (Т=const) объем данной массы газа обратно пропорционален давлению, производимому газом.
P1V1=P2V2=PnVn=const
О![]() бъединив
эти два закона и обозначив состояние
газа при нормальных условиях через P0,
V0, T0
получим уравнение Клапейрона
бъединив
эти два закона и обозначив состояние
газа при нормальных условиях через P0,
V0, T0
получим уравнение Клапейрона
с![]() помощью которого можно привести объем
любого газа к нормальным условиям (н.у.)
помощью которого можно привести объем
любого газа к нормальным условиям (н.у.)
При н.у.
Р0=101,325 кПа, или 1 атм. или 760 мм рт. ст.
Т0=273 К, или 00С, V0=22.4 л.
Отношение постоянных величин есть величина постоянная
R![]() – газовая постоянная имеет разную
размерность.
– газовая постоянная имеет разную
размерность.
R1=8.314 Дж/моль*К,
R2=1.987 кал/моль*град,
R3=0.082л*атм/моль*град.
У![]() равнение
Клапейрона для n-молей газа будет иметь
вид
равнение
Клапейрона для n-молей газа будет иметь
вид
P![]() 1V1=
n*RT, где
1V1=
n*RT, где
и![]()
![]() ли
ли
Это уравнение Клапейрона-Менделеева, с помощью которого можно находить m – массу, М – молярную массу, Р – давление, V – объем, Т – температуру при решении задач.
Закон Авогадро. Молярный объем. Относительная плотность газов.
Закон Авогадро(1811г). В равных объемах любых газов при одинаковых условиях содержится равное число молекул.
Один моль любого газообразного или парообразного вещества занимает при нормальных условиях объем 22,4 л, такой объем называют молярным,обозначают Vm, размерность – л/моль, см3/моль:
Vm=22,4 л/моль
М![]() ассы
любых, но равных объемов газов, содержащие
равное число молекул относятся между
собой как их молярные массы:
ассы
любых, но равных объемов газов, содержащие
равное число молекул относятся между
собой как их молярные массы:
Д – относительная плотность газа безразмерная величина, показывает во сколько раз масса данного газа тяжелее или легче по отношению к массе такого же объема другого газа. Относительную плотность обычно определяют по водороду М(Н2)=2г/моль или воздуху Мвозд=29г/моль. Зная относительную плотность (Д) можно определить молярную массу газа М1=Д*М2 или массу m1=Д*m2
Основная литература: [1] – стр. 14-16; 86,87; [2] – стр. 7-19; [3] – стр. 15-30; [4] – стр. 17-25.
Дополнительная литература: [6] – cтр. 13-27, [11] – стр. 5 – 18 [12] – стр. 12-31, [13] – стр. 10-34 [23] – стр. 14 – 55, [24] – стр. 6-29, [25] – стр. 7-66.
Контрольные вопросы:
Основные положения атомно-молекулярной теории.
Дайте определение понятий: атом, молекула, элемент, ион, простое вещество, сложное вещество.
Сформулируйте закон постоянства состава. В чем заключается относительный характер этого закона?
Дайте определение единицы количества вещества – моль.
Изложите закон Авогадро и его два следствия.
Напишите формулу уравнения Менделеева-Клапейрона.
Что называется эквивалентом элемента т эквивалентом сложного вещества?
Как вычислить молярные массы эквивалентов, кислоты, основания, соли?
Сформулируйте закон эквивалентов.
Тема лекции 3: Электронное строение атома. Квантово-механические представления о строении атомов. Строение молекул. Теории строения атомов по Резерфорду, Бору. Квантовые числа. Принцип Паули. Правила Гунда, Клечковского I и II. Атомные ядра, их состав. Изотопы, изобары.
Периодический закон Д.И. Менделеева. Электронная структура атомов. Структура периодической системы. Изменение атомных характеристик (энергия ионизации, сродства к электрону, электроотрицательности, радиусов атомов и ионов). (2 часа).
Планетарная модель атома Э. Резерфорда. Основоположником современного учения об атоме является английский физик Э. Резерфорд.
По отклонению -частиц, было установлено, что вся положительно заряженная материя атома сосредоточена в его ядре. На основании чего была построена планетарная модель атома водорода в 1911 году, которая имела два существенных недостатка.
1 При вращении электрон должен непрерывно терять энергию в виде излучения, при этом чтобы сохранить момент количества движения, он постоянно приближается к ядру, и наконец, должен упасть на ядро. В действительности, атом устойчивая система.
2 Непрерывному излучению должен соответствовать сплошной спектр. В действительности он линейчатый.
Как известно, атом имеет сложное строение: он состоит из тяжелого нейтрального ядра, обладающего положительным электрическим зарядом, и вращающихся вокруг него на сравнительно далеком расстоянии электронов – значительно более легких частиц с отрицательным электрическим зарядом. Электроны в атоме удерживаются электрическими силами, действующими между положительно заряженным ядром и отрицательно заряженными электронами.
Заряд атомного ядра по величине совпадает с порядковым номером элемента в периодической системе; число электронов равно заряду ядра.. Атом в целом нейтрален, т. е. сумма отрицательных зарядов компенсирована положительным зарядом ядра. Размеры атомного ядра (диаметр 10-12–10-13 см) весьма малы по сравнению с размерами атома (диаметр ~ 10-8 см), но почти вся его масса сосредоточена в ядре (~-99,97%). А так как масса является мерой энергии, то в ядре сосредоточена почти вся энергия атома. Плотность ядерного вещества "огромна" (–1,4-1014 г/см3). Заряд ядра определяет не только общее число электронов, но и электронное строение атомов, а следовательно, их физико-химические свойства.
Ядра атомов всех элементов, за исключением ядра легкого изотопа водорода, состоят из протонов и нейтронов. Эти частицы имеют общее название нуклоны.
Протон (обозначается символом Р или iP) – устойчивая элементарная частица с массой покоя 1,67252 10-24 г, относительная атомная масса 1,00728 по углеродной шкале. Заряд протона – положительный элементарный, т.е. по величине равен заряду электрона 4,803-10-10 CGSE, или 1,602 10-19 кулона (Кл).
Нейтрон, (обозначается символом n или in) – неустойчивая, электрически нейтральная элементарная частица с массой 1,6747-10-24 г, или 1,008665 углеродных единиц.
Протон и нейтрон, являясь по существу лишь разными квантовыми состояниями одной и той же частицы – нуклона, могут взаимно превращаться. Число протонов в ядре определяет величину положительного заряда ядра Z. Массовое число А равно сумме протонов Z и нейтронов N, входящих в состав ядра: A=Z+N. Следовательно, число нейтронов N в ядре атома любого элемента равно разности между массовым числом А и числом протонов Z: N=A - Z. Так, например, если массовое число ядра атома магния 24, порядковый номер 12, то число нейтронов N=A—Z = 24—12 = 12. Разновидности химических элементов, характеризующиеся одинаковым числом протонов {зарядом ядра), но различным числом нейтронов {а, следовательно, и разным массовым числом), называют изотопами.
Например, в ядре изотопа хлора с массовым числом 35 (17 CI) 18 нейтронов, а в ядре изотопа с массовым числом 37 (17CI) 20 нейтронов, плеяда кислорода состоит из трех
16 17 18
изотопов gO.
Изотопы разных элементов, атомы которых имеют одинаковые массовые числа, но различные заряды ядра атома, называются изобарами. Например: 50 Sn, 52 Те, 52 Xe.
Естественно, что изобары обладают различными свойствами.
Теория Н. Бора была предложена в 1913 году, в ней использовалась планетарная модель Резерфорда и квантовая теория Планка-Эйнштейна. Планк считал, что наряду с пределом делимости материи – атом, существует предел делимости энергии - квант. Атомы излучают энергию не непрерывно, а определенными порциями квантами
Е=h*V.
Первый постулат Н. Бора: существуют строго определенные разрешенные, так называемые стационарные орбиты; находясь на которых электрон не поглощает и не излучает энергию. Разрешенными являются только те орбиты, для которых момент количества движения равный произведению me*V*r, может меняться определенными порциями (квантами), т.е. квантуется.
Состояние атома с n=1 называют нормальным, при n=2.3… - возбужденным.
Скорость электрона с увеличением радиуса уменьшается, кинетическая и общая энергия возрастает.
Второй постулат Бора: при переходе с одной орбиты на другую электрон поглощает или излучает квант энергии.
Едальн-Еближ=h*V. Е=-21,76*10-19/n2Дж/атом=-1310 кДж/моль
Такую энергию надо затратить, чтобы перевести электрон в атоме водорода с первой боровской орбиты (n=1) на бесконечно удаленную, т.е. оторвать электрон от атома, превратив его в положительно заряженный ион.
Квантовая теория Бора объяснила линейчатый характер спектра атомов водорода. Недостатки
1 Постулируется пребывание электрона только на стационарных орбитах, как же в таком случае совершается переход электронов?
2 Не объясняется все детали спектров их разная толщина
3 Нельзя количественно рассчитать химическую связь
Квантовые числа.
Имеются четыре квантовых числа.
1 Главное квантовое число n – принимает целочисленные значения от 1 до или буквенные Числовое значение . n=1 2 3 4 5 6 7…
Буквенное обозначение K L M N O P Q
max значение n соответствует числу энергетических уровней в атоме и соответствует номеру периода в таблице Д.И. Менделеева, характеризует величину энергии электрона, размер орбитали. Главное квантовое число п характеризует энергию электрона на данном энергетическом уровне, его удаленность от ядра, т. е. размер атомной орбитали.
Состояние электрона, характеризующееся определенным значением главного квантового числа (n), называют энергетическим уровнем электрона в атоме. Так, при п=1 электрон находится на первом энергетическом уровне. Элемент с n=3 имеет 3 энергетических уровня, находится в третьем периоде, обладает большим размером электронного облака и энергией, чем элемент с n=1. При n=4 электрон находится на четвертом энергетическом уровне (или на N уровне). Иными словами, совокупность электронов в атоме, обладающих одинаковым значением п, называют энергетическим уровнем, или электронным слоем, или электронной оболочкой.
2 Орбитальное (побочное, или азимутальное) квантовое число l принимает значения в зависимости от главного квантового числа и имеет соответствующие буквенные значения.
l = 0, 1, 2, 3… n-1
или s p d f
l – характеризует форму орбиталей:

S
Энергетические уровни представляют собой совокупность некоторых энергетических подуровней (или подоболочек). Число возможных подуровней для данного энергетического уровня равно номеру уровня или значению п. Так, например, при п=1 (в первом энергетическом уровне) только 1 подуровень sy максимальное число электронов, размещающихся на нем, 2 (s2). В данном случае уровень и подуровень совпадают. При п=2 (во втором энергетическом уровне) имеется два подуровня: s-подуровень — 2 электрона и р-подуровень – 6 электронов (s2p6). При п=3 (в третьем энергетическом уровне) три подуровня: s-подуровень—2 электрона, р-подуровень – 6 электронов, d-подуровень – 10 электронов (всего 18 электронов – s2p6dm). При п=4 (в четвертом энергетическом уровне) четыре подуровня: s-подуровень– 2 электрона, р-подуровень – 6 электронов, d-подуровень – 10 электронов, f-подуровень – 14 электронов (всего 32 электрона s2p6d10f !4)..Больше 4 подуровней в невозбужденном атоме не заполняется.
Орбитали с одним и тем же значением n, но с разными значениями l различаются несколько по энергии, т.е. уровни делятся на подуровни.
Главное квантовое число n |
Орбитальное квантовое число l |
Буквенное обозначение подуровней |
Число подуровней |
1 |
0 |
S |
1 |
2 |
0 1 |
S P |
2 |
3 |
0 1 2 |
S P D |
3 |
4 |
0,1,2,3 |
Spdf |
4 |
Число возможных подуровней равно главному квантовому числу.
3 Магнитное квантовое число me принимает значения от -l,…0…,+l.
Для s |
l=0 |
me=0 |
P |
l=1 |
me=-1 0 +1 |
D |
l=2 |
me=-2 –1 0 +1 +2 |
F |
l=3 |
me=-3 –2 –1 0 +1 +2 +3 |
Число возможных значений магнитного квантового числа определяет число орбиталей данного вида. В пределах каждого уровня может быть только
одна s – орбиталь, т.к. me=0 при l =0
три р – орбитали, me= -1 0 +1, при l l=1
пять d – орбиталей me=-2 –1 0 +1 +2, при l =2
семь f – орбиталей.
Магнитное квантовое число определяет ориентацию орбиталей в пространстве.
S-орбиталь Р-орбиталь d-орбитали

Х х
у z x и т.д.
z у
у
z dz2
Энергетическое состояние электрона в атоме, отвечающее определенным
![]()

Рис. I. Формы электронных орбиталей для различных состояний электронов в атомах
значениям п и I, записывается таким образом: сначала цифрой указывается значение главного квантового числа, а затем буквой – орбитальное квантовое число.
Движение электрона по замкнутой орбитали связано с возникновением магнитного поля. Орбитальный момент количества движения неразрывно связан с магнитным полем движущегося электрона. И, следовательно, магнитные характеристики движения электрона связаны с орбитальным квантовым числом I:
Магнитное квантовое число характеризует расположение орбитали в пространстве. Число различных расположений орбиталей в пространстве и определяется магнитным квантовым числом т. Для каждого данного значения квантового числа l магнитное квантовое число может принимать значения любых целых чисел, как положительные, так и отрицательные, включая и 0. Число возможных значений магнитного квантового числа при данном l равно 2 l +1. Например, при 1 = 2 т имеет 2 l +1 =2*2+1 =5 значений
(-2 -1, 0, +1. +2); при l =3 m может, иметь семь значений:
2 l +1 = 2-3+l=7 (–3, –2, –, 0, +1, +2, +3). Таким образом, для различных значений l число возможных значений т различно. Число значений магнитного квантового числа, равное 2l+1 — это число энергетических состояний (т.е. орбиталей), в которых могут находиться электроны данного подуровня.
Следовательно, s-электроны (l = 0) имеют лишь одно состояние (2 l +1 = 1). р-электроны (l = 1) имеют 3 состояния (2 l +1 =3), d-электроны (l = 2) и f-электроны (l = 3) имеют соответственно 5 и 7 состояний (т.е. возможных расположений орбиталей или электронного облака в пространстве). Электронные облака всех трех р-орбиталей (рис. 1) соответственно вытянуты по координатным осям х, у, z, поэтому их обозначают как рх, ру и рz-орбитали. Орбитали с одинаковой энергией называются вырожденными.
4 Спиновое квантовое число (спин) ms. Исследования атомных спектров привели к выводу,, что помимо квантовых чисел п, I и m электрон обладает движением вокруг собственной оси. Это движение получило название «спина» {от английского spin — веретено, вращение). Упрощенно спин электрона можно представить как его вращение вокруг собственной оси по часовой стрелке или против нее (т. е. в двух прямо противоположных направлениях, обозначаемых знаками (+ и —).
Спиновое квантовое число s может иметь только два значения: + 1/2 и –1/2 (это зависит от того, параллельно или антипараллельно магнитному полю, обусловленному движением электрона вокруг ядра, ориентируется магнитное поле спина электрона).
![]() или
или![]()
Спин характеризует магнитный момент электрона, обусловленный вращением электрона вокруг собственной оси по часовой и против часовой стрелки.
Обозначив электрон стрелкой , а орбиталь черточкой или клеточкой можно показать

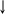

![]() ,
,
![]()

или
С хематически
орбитали в порядке возрастания энергии
снизу вверх располагаются так
хематически
орбитали в порядке возрастания энергии
снизу вверх располагаются так
E 7p
- - -
6d
5f
7S - - - - - - -
6p
- - -
5d
- - - - -
4f
6S - - - - - - -
5p
- - -
4d
5S - - - - -
 4p
4p
- - -
3d
4S - - - - -
3p
- - -
3S
2p
- - -
2S
1S
Правила, характеризующие порядок заполнения орбиталей. Принцип Паули.
П ринцип
Паули: в атоме не может быть двух и более
электронов с одинаковым
ринцип
Паули: в атоме не может быть двух и более
электронов с одинаковым
Распределение электронов в атомах определяется следующими основными положениями: 1) принцип Паули, 2) принцип наименьшей энергии и 3) правило Гунда.
Принцип Паули. В 1925 г. шведский физик Вольфганг Паули, изучая спектры атомов, установил правило, названное по его имени принципом или запретом Паули: в атоме не может быть двух и более электронов, характеризующихся одинаковыми значениями всех четырех квантовых чисел. Так, например, электроны с. одинаковыми квантовыми числами n, I и m должны обязательно различаться спинами. Если главное квантовое число равно n, то, согласно принципу Паули, максимальное число электронов N на этом уровне должно быть N= n2, где а – номер уровня. Следовательно, в первом уровне не может быть более двух электронов, во втором более 8.и т. д. Максимальное число электронов в подуровне равно 2(2 l +1) .
Подуровень делится на квантовые ячейки (энергетические состояния). Число ячеек в каждом подуровне определяется числом возможных.значений m, т. е. равно 2 l +1.
И з
чего следует, что на одной орбитали
могут находиться два электрона с
противоположно направленными спинами
.
з
чего следует, что на одной орбитали
могут находиться два электрона с
противоположно направленными спинами
.
Н а
s – подуровне
- одна орбиталь – 2 электрона, т.е. s2
а
s – подуровне
- одна орбиталь – 2 электрона, т.е. s2
На p- – -три орбитали – 6 электронов, т.е. р6.
На d - – - пять орбиталей – 10 электронов, т.е. d10.
На f- –– - семь орбиталей – 14 электронов, т.е. f14.
Число орбиталей на подуровнях определяется 2l+1, а число электронов на них будет 2. (2l+1) число орбиталей на подуровнях равно квадрату главного квантового числа n2, а на уровнях - 2n2, т.о. в первом периоде периодической системы элементов максимально может быть 2 элемента, во втором – 8, в третьем – 18 элементов, в четвертом – 32.
Принцип наименьшей энергии. Максимальная устойчивость атома (как системы) соответствует минимуму его полной энергии. В атоме каждый электрон стремится занять положение, соответствующее минимальному значению энергии, что отвечает наибольшей его связи с ядром. Последовательность заполнения энергетических уровней и подуровней в атоме электронами происходит в соответствии с принципом наименьшей энергии.
Энергия электрона в основном определяется главным квантовым числом п и побочным l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и / является меньшей (правило Клечковского).
Например, запас энергии на подуровне 4s меньше, чем на 3d, так как. в первом случае n+ l=4+0=4, а во втором n+ l= =3+2=5; на 5s[n+ l=5+0=5] меньше, чем на 4d [n+l= =4+2=6]; на 5р[n+ l=5+1=6] меньше, чем на 4f [n+l= =4+3=7].
В случае, когда для двух подуровней суммы значений п и l равны, сначала идет заполнение подуровня с меньшим значением п. Так, например, на подуровнях 3d, 4р, 5s сумма значений п и l равна 5. В данном случае происходит сначала заполнение подуровней с меньшими значениями п, а именно: 3d>-4p~ 5s. Из этого правила встречаются некоторые исключения, когда энергии близких подуровней очень мало отличаются друг от друга.
Правило Гунда. Заполнение ячеек электронами происходит по правилу Гунда, согласно которому в пределах подуровня электроны располагаются сначала каждый в отдельной ячейке (в виде так называемых «холостых»— валентных электронов), затем, когда все ячейки данного подуровня окажутся занятыми, начинается уплотнение электронов вновь поступающими, т. е. их «спаривание». Иначе говоря, электроны в пределах данного подуровня (s, p, d, f) заполняются таким образом, чтобы суммарный спин был максимальным. Так, например,: если в трех ячейках (атома азота) необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке:
-
—в этом случае суммарный спин равен 3/2.
-
Сложение спинов производится по правилу сложения векторов, так как спин электрона, определяющий величину собственного момента количества движения электрона, является вектором.
Следовательно, заполнение энергетических уровней в атомах происходит таким образом, что при обычном состоянии атомов в первую очередь заполняются наиболее низкие энергетические уровни. В целом строение электронных оболочек атомов связано с периодической системой элементов.
Чем ближе к ядру концентрируется электронная плотность, тем прочнее связан электрон. Электроны каждого следующего уровня находятся на более высоком энергетическом уровне, чем электроны предыдущего уровня. Поэтому, когда электроны расположены в первом, ближайшем к ядру квантовом слое, атом характеризуется минимальным запасом энергии. Напротив, если электроны находятся в наиболее удаленном от ядра седьмом квантовом слое, атом обладает наибольшим запасом энергии.
В соответствии с I и II правилами Клечковского М. В. Заполнение орбиталей происходит в порядке возрастания суммы (n+ l), при равенстве, с n – наименьшей.
Значения l для s – 0, p – 1, d – 2, f – 3.
-
Значения
Электронные
N
L
n+l
состояния
3
0
3
3s
3
1
4
3p
4
0
4
4s
4
1
5
4p
3
2
5
3d
5
0
5
5s
Электронные формулы записываются следующим образом:
1 В виде числового коэффициента указывают номер энергетического уровня.
2 Приводят буквенные обозначения подуровня.
3 Число электронов в данном энергетическом подуровне указывают в виде показателя степени, при этом все электроны данного подуровня суммируются.
Размещение электронов в пределах данного подуровня подчиняется правилу Гунда: В данном подуровне электроны стремятся занять максимальное число свободных орбиталей, так, чтобы суммарный спин был максимальным.
Примеры электронных и электронно-графических формул атомов элементов.
Период |
Элемент |
Электронная формула |
Электронно-графическая |
|
||||||||||
I |
1H |
1s1 |
|
|
||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||
II |
5B |
1s22s22p1 |
|
|
||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||
II |
10Ne |
-/- 2s22p6 |
|
|
||||||||||
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||
IV |
24Cr |
4s13d5 |
|
|
|
|
|
|
||||||
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||
IV |
25Mn-30Zn |
4s23d10 |
|
|
|
|
|
|
||||||
Периодический закон Д.И. Менделеева. Электронная структура атомов. Структура периодической системы. Изменение атомных характеристик (энергия ионизации, сродства к электрону, электроотрицательности, радиусов атомов и ионов).
Одним из важнейших законов природы является периодический закон. Установлен в 1869 г великим русским химиком Д.И. Менделеевым: свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов.
В настоящее время периодический закон Д. И. Менделеева формулируется следующим образом: свойства элементов, а также форма и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Индивидуальность атома сохраняется до тех пор, пока сохраняется целостность его ядра.
С развитием естествознания, в частности, с созданием теории строения атома было показано, что свойства элементов зависят от зарядов атомных ядер. Заряд ядра определяет электронное строение атома, которое периодически повторяется. Современная формулировка периодического закона: свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома (или Z).
Выражением периодического закона является периодическая система элементов, отражающая закономерности электронного строения атомов.
Структура ПСЭ. Периодическая система состоит из горизонтальных рядов – периодов и вертикальных рядов – групп.
Период – это последовательный ряд элементов, в атомах которых происходит заполнение одинаковых квантовых слоев. Номер периода совпадает со значением главного квантового числа n внешнего энергетического уровня. В таблице 7 периодов, что соответствует семи значениям главного квантового числа.
1, 2, 3 периоды – малые; 4, 5, 6, 7 периоды – большие, состоят из двух рядов.
В первом периоде – два s-элемента, во втором, третьем периодах – 8 элементов (два s и шесть p); в четвертом, пятом периодах – 18 элементов (два s, десять d и шесть p); в шестом периоде – 32 элемента (два s, десять d, четырнадцать f и шесть p); седьмой период – незакончен.
Э |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
I1, эВ |
5,138 |
7,644 |
5,984 |
8,149 |
10,484 |
10,357 |
13,01 |
15,755 |
Следующие максимумы отвечают элементам V группы N, P, As, что соответствует энергетически выгодному половинному заполнению р-подуровня. У элементов VI группы (O, S, Se) I1 снова снижается.
В подгруппах s и р-элементов с увеличением заряда ядра I1 уменьшается. Это объясняется усиливающимся экранированием заряда ядра электронами внутренних слоев. В подгруппах d элементов I1 увеличивается.
Сродством к электрону называется энергия, которая выделяется при присоединении электрона к атому (иону или молекуле). Выражается также в Дж или эВ. Можно сказать, что сродство к электрону – мера окислительной способности частиц. Надежные значения Е найдены лишь для небольшого числа элементов.
Наибольшим сродством к электрону обладают р-элементы VII группы (галогены), так как присоединяя один электрон к нейтральному атому они приобретают законченный октет электронов.
E(F) = 3,58 эВ, Е(Cl) = 3,76 эВ
Наименьшие и даже отрицательные значения Е имеют атомы с конфигурацией s2 и s2p6 или наполовину заполненным р-подуровнем.
Е(Mg) = -0,32 эВ, Е(Ne) = -0.57 эВ, Е(N) = 0,05 эВ
Присоединение последующих электронов невозможно. Так, многозарядные анионы О2-, N3- не существуют.
Электроотрицательностью называется количественная характеристика способности атома в молекуле притягивать к себе электроны. Эта способность зависит от I и Е. По Малликену: ЭО = (I+E)/2.
Электроотрицательности элементов по периоду возрастают, по группе – уменьшаются.
Основная литература: [1] – стр. 17-34; [2] – стр. 34-55; [3] – стр. 48-93; [4] – стр. 46-73
Дополнительная литература: [6] – стр. 30-48, [11] – стр. 19–69, [12] – стр. 53-74, 166-197, 467-474, [13] – стр. 34-63, [23] – стр. 55-135, [24] – стр. 30-70, [25] – стр. 64-93.
Контрольные вопросы:
Как полностью описать состояние электрона в атоме?
Как называются и что характеризуют квантовые числа?
Чем определяется число орбиталей и число электронов данного энергетического уровня?
4. В чем заключается принцип Паули? Какое важное следствие он имеет?
5. Как идет заполнение электронов по правилам Правила Гунда, Клечковского I и II.
6. Атомные ядра, их состав?
7. Чем отличаются изотопы и изобары?
8. Дайте современную формулировку периодического закона.
9. Какие характеристики атома можно назвать, зная: а) порядковый номер элемента; б) номер периода; в) номер группы?
10. Как объяснить периодическую повторяемость свойств элементов с точки зрения электронного строения их атомов?
Тема лекции 4: Химическая связь, ее природа. Важнейшие типы химической связи. Ковалентная связь. Валентность атомов. Метод валентных связей (МВС).
Строение молекул. Гибридизация атомных орбиталей. Метод молекулярных орбиталей (ММО). Парамагнетики, диамагнетики, кратность связи. Ионная связь. Водородная связь. (2 часа).
Метод валентных связей (МВС)
Представление о химической связи развивалось в двух направлениях:
Электростатическая теория Косселя: химическая связь как следствие притяжения равноименно заряженных ионов.
Теория Льюиса: образование ковалентной химической связи за счет общей электронной пары атомов (1916г).
Представления Льюиса были развиты ученым Полингом и легли в основу теории метода валентных связей (МВС), согласно которого связь осуществляется парой элементов с антипараллельными спинами. Повышенная электронная плотность, удерживает ядра двух атомов.
Основные характеристики химической связи
1 Длина связи- кратчайшее межъядерное расстояние химически связанных атомов.
2 Энергия связи- количество энергии, необходимой для разрыва связи. Энергия связи является мерой ее прочности, большей энергии связи соответствует меньшая ее длина, например
-
HF
HCl
HBr
HI
E, кДж/моль
565
431
364
297
d, нм (1нм=10-9М)
0,092
0,128
0,141
0,160
3 Полярность связи обуславливается смещением электронной пары к одному из атомов (ковалентная полярная, ионная).
4 Насыщаемость связи – способность образовывать ограниченное число химических связей.
5 Направленность связи, т.е. взаимное расположение в пространстве атомов, образующих химическую связь от чего зависит форма молекулы: линейная, угловая, треугольная, тетраэдрическая и др.
Механизм образования химической связи
Образование общей электронной пары может происходит по обменному механизму: каждый из атомов- партнеров предоставляет по одному неспаренному электрону или по донорно-акцепторному механизму: один атом (донор) предоставляет пару электронов, а другой (акцептор) – вакантную, свободную орбиталь.
Валентно-возбужденные состояния атомов
Валентные возможности элементов определяются в первую очередь числом неспаренных электронов. Высшая валентность элементов главных подгрупп достигается распариванием электронов одного энергетического уровня на разные подуровни.
Рассмотрим как происходит распаривание электронов у s- и p-электронов.
Нормальное состояние |
Вн |
Возбужденное состояние |
Вв |
Примеры |
||||||
3Li 1s22s1 |
Вн=1 |
1s22s1 |
Вв=1 |
LiF, LiOH |
||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
4Be 1s22s2 |
Вн=0 |
1s22s12p1 |
Вв=2 |
BeCl2, BeO, |
||||||
|
|
|
|
Be(OH)2, BeF2 |
||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
Кратность связи
В образовании химической связи может участвовать одна электронная пара, кратность связи равна единице две электронные пары или три, кратность связи соответственно равна двум и трем или двойная и тройная химическая связь.
Рассмотрим электронное строение молекулы кислорода и некоторых молекул с кратными связями.
молекула кислорода
8O – 2s22p4
|
|
|
|
|
z |
у |
х |
.. .. .. ..
а) :О:+:О: :О::О: О=О О2
в



 )
+
)
+


 -связь
-связь

с



 )
x +
х х О=О
)
x +
х х О=О

у у у
Связь образованная перекрыванием электронных р-облаков выше и ниже оси х называется -связь, в молекуле кислорода одна - и одна - связи.
молекула азота
7N – 2s22p3
|
|
|
|
|
х |
у |
z |
. . ..
:N: + :N: :N::N: NNN2
в)
2s2 2p3 2p3 2s2
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
N |
|
N |
|
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



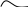





с

 )
x + x
x N
N
N2
)
x + x
x N
N
N2

у z у z у z у z
в молекуле азота три неспаренных электрона, находящихся на трех взаимноперпендикулярных орбиталях образуют одну - и две -связи.
Чем выше кратность связи, тем она прочнее, тем меньше длина связи, т.е. расстояние между ядрами атомов.
Электронное строение многоатомных молекул.
Направленность химических связей
Молекулы типа АА или АВ: F2, Cl2, Br2, I2, At2, HF, HCl, HBr, HI, HAt.
Рассмотрим молекулу F2.
9F – 2s22p5
|
|
|
|
|
|
|
|
P p
 +
x F2
+
x F2
F F F-F
форма молекулы F2 – линейная (угол связи 1800) одна -связь, ковалентная неполярная.
Молекула НF образована водородом –s элементом и фтором р – элементом.
 s p
s p
H x + F x H-F HF
Форма молекулы НF – линейная, одна - связь, ковалентная полярная.
Молекулы типа А2В; Н2О, Н2S, H2Se, H2Te.
М олекула
Н2О
– образована двумя атомами водорода –
s-элементами и атомами кислорода
р-элементом.
олекула
Н2О
– образована двумя атомами водорода –
s-элементами и атомами кислорода
р-элементом.
 s
s
8 О
– 2s22p4
1H-1s1
О
– 2s22p4
1H-1s1
|
|
|
|
|
|
|
|
 H
O
H
O

 + s
H
O H2O
+ s
H
O H2O




H H
H H
H H 1050
Форма молекулы воды – угловая, за счет отталкивания одноименно заряженных атомов водорода происходит расширение валентного угла, 2-связи, ковалентная полярная.
Молекулы типа А3В: NH3, PH3, AsH3, SbH3,BiH3.
Молекула NH3 образована тремя атомами водорода и атомом азота, имеющего три р-облака ориентированных в пространстве по осям координат х,у,z.
7N – 2s22p5
|
|
|
|
|
|
|
|

 s
s

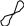

 + s
H
NH3
+ s
H
NH3

s H H
Молекула аммиака представляет собой треугольную пирамиду, имеет 3-связи, угол между связями 107,30, связь ковалентная полярная.
Отличие угла связи в молекулах воды и аммиака от 900 свидетельствует о их тетраэдрическом строении, т.е. в одной из вершин тетраэдра находится неподеленная пара электронов.
Строение молекул. Гибридизация атомных орбиталей. Метод молекулярных орбиталей (ММО). Парамагнетики, диамагнетики, кратность связи.
От одного и того же атома в образовании химической связи могут одновременно участвовать s- и р- орбитали, при этом они смешиваются и образуются гибридные электронные облака. Тип гибридизации: sp, sp2 или sp3-центрального атома, участвующих в образовании -связей, определяет геометрии молекулы. Ниже приведены примеры часто встречающихся типов гибридизации орбиталей и соответствующих им геометрических форм молекул.
Несмотря на полярность связей, все рассмотренные молекулы, где имеет место sp-, sp2-, sp3-гидридизация- неполярны, т.к. геометрические центры отрицательных и положительных зарядов в молекулах совпадают. Возможны и другие типы гибридизации, например: одной s-, трех р- и одной d-орбиталей с образованием тригональной бипирамиды.
Орбитали центрального атома, участвующие в образовании -связей |
Тип гибридизации. Форма молекулы. Угол между связями |
Примеры молекул |


 МgCl2,
CaF2,
BeH2,
МgCl2,
CaF2,
BeH2,
x sp,1800 BeI2, BaCl2, BaH2,
s+p линейная SrF2, SrI2
 AlCl3, AlH3,
BH3,
AlCl3, AlH3,
BH3,
 x
BF3, GaI2,
GaCl3
x
BF3, GaI2,
GaCl3
у
s+p+p sp2, 1200

 треугольная
треугольная







 SiCl4, SiH4,
CCl4,
SiCl4, SiH4,
CCl4,
 CH4, CF4,
GeCl4
CH4, CF4,
GeCl4
sp3, 1090
s+p+p+p тетраэдрическая
Полярность связи
Перекрывание орбиталей, образующих -связь, может происходить на равном расстоянии от ядер атомов одного элемента (H2, F2, Cl2, Br2, I2), такая связь называется ковалентной неполярной и может быть смещено к одному из атомов.
В случае образования молекул HI, HCl, HBr, HF – такая связь называется ковалентной полярной.
Метод молекулярных орбиталей
С помощью метода ВС нельзя объяснить строение целого ряда молекул и молекулярных ионов Не2+, Н2+, Со-, No+ и др. Метод молекулярных орбиталей является линейной комбинацией атомных орбиталей. Заселение молекулярных орбиталей электронами происходит в соответствии с принципом Паули, принципом наименьшей энергии и правилом Гунда. На одной молекулярной орбитали могут находиться не более двух электронов с противоположными спинами. В первую очередь заселяются те молекулярные орбитали, на которых энергия электронов меньше.
Количество молекулярных орбиталей в молекуле равно сумме атомных орбиталей атомов, входящих в молекулу. При образовании молекулы из двух атомных орбиталей образуются две молекулярные орбитали, из которых одна орбиталь связующая, а другая – разрыхляющая. Энергия электронов на связующей орбитали ниже, чем на разрыхляющей, поэтому она заселяется электронами в первую очередь.
Согласно методу МО порядок связи (кратность) равен полуразности чисел электронов на связующих и разрыхляющих молекулярных орбиталях. Если кратность связи равна нулю – молекула не образуется, если имеет целое или дробное значение – молекула существует.
Магнитные свойства молекулы определяется наличием (парамагнетик) или отсутствием (диамагнетик) неспаренных электронов.
Рассмотрим образование молекулы и молекулярных ионов Не2+ и Со-.
AO |
MO |
AO |
|
1 ) H0 H2 H0
 разр
1s
разр
1s

 1s
1s
св 1s2
![]()
 Н2
- диамагнетик
Н2
- диамагнетик
2 ) He0 разр 1s1 He+

 1s2
1s1
1s2
1s1
св 1s2
![]()
Н2 - парамагнетик
3) N2, 7N – 1s22s22p3 – внутренние (1s2) четыре электрона двух атомов азота практически не оказывают влияния на химическую связь т.к. они располагаются на двух связующих и двух разрыхляющих орбиталях, выигрыша энергии не происходит, аналогично и с электронами 2s2. Три р- электрона 2р3 – образуют одну и 2 связи
разр 2ру разр 2рz
разр 2р


![]() ,
N2 -
диамагнетик
,
N2 -
диамагнетик
N0 2p3
св 2р

св 2ру св 2рz
в молекулярном ионе СO- кислород принимает электрон
разр 2ру разр 2рz
разр 2р
![]()
С 0 2р2 O-1 CO- - парамагнетик
св 2р
св 2ру св 2рz
Другие виды химической связи
1. Координативная или донорно-акцепторная связь возникает при взаимодействии неподеленной пары электронов – свободная орбиталь. Компонент А предоставляющий неподеленную пару электронов называют донором, а В – свободную орбиталь – акцептор.
А : + В А : В
Донор акцептор
N: + Н+ NH4+.
2. Металлическая связь осуществляется в кристаллах металлов и их сплавов. Твердый металл представляет собой каркас из положительных ионов, находящихся в узлах решетки кристалла и погруженных в море подвижных электронов, обобществленные электроны могут находиться около двух и более положительных ядер одновременно. Этим и объясняются все общие свойства металлов тепло- и электропроводность, вытягиваться в проволоку и прокатываться в листы, высокая температура кипения и плавления и др.
Me+n Me0 Me+n

Me0 Me+n Me0
Металлическая связь в 3-4 раза менее прочна (следствие делокализации), чем ковалентная.
3. Водородная связь образуется при взаимодействии водорода с электроотрицательными элементами, она наиболее характерна для соединений фтора, кислорода и в меньшей степени для соединений азота, серы и хлора. Схематически водородную связь изображают тремя точками, например
Н-О…Н-О…
Н Н
Н-F…H-F…H-F
Водородная связь гораздо слабее ковалентной, однако ее достаточно, чтобы происходила димеризация, полимеризация.
В рядах Н2ОН2SH2SeH2Te
Tкип, К 373 213 232 271
HF HCl HBr HI
253 189
Аномально высокие значения температур кипения воды и фторводорода объясняются образованием водородных связей между молекулами этих веществ.
Основная литература: [1] – стр. 35-71; [2] – стр. 56-100; [3] – стр. 95-104; 112-121; [4] – стр. 76-114.
Дополнительная литература: [6] – стр. 109-149, [11] – стр. 70–95, [12] – стр. 74-94, [13] – стр. 64-89, [23] – стр. 113-143, [24] – стр. 71-130, [25] – стр. 86-117.
Контрольные вопросы:
Что является причиной образования химической связи?
Какова природа химической связи?
Дайте определение ковалентной связи. Назовите ее свойства.
Каковы два механизма образования ковалентной связи?
Что называется гибридизацией атомных орбиталей? Какие ее типы?
Дайте определение ионной связи. Какими свойствами она обладает?
В чем заключаются основные положения метода молекулярных орбиталей?
Как по методу МО-ЛКАО образуются связывающие и разрыхляющие молекулярные орбитали?
Как метод МО-ЛКАО объясняет магнитные свойства частиц, порядок связи?
Какая химическая связь называется водородной? Между какими молекулами она образуется?
Тема лекции 5: Общие закономерности протекания химических реакций. Энергетика химических превращений. Химическая термодинамика. Первый и второй законы термодинамики. Изобарно-изотермический эффект. Энтальпия. Тепловой эффект химической реакции. Внутренняя энергия. Закон Гесса. Энтропия. Энергия Гиббса.
Химическая кинетика. Скорость и механизм протекания химических реакций. Закон действующих масс. Правило Вант-Гоффа. Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье. Понятие о катализе. (2 часа).
Основным вопросом химии является вопрос о химических реакциях:
1. скорость и механизм, по которому протекает химическое превращение (изучает химическая кинетика);
2. возможность самопроизвольного химического превращения и его глубина (изучает химическая термодинамика).
Реакционную способность химических соединений и направление химических реакций можно предсказать, изучив термодинамические или энергетические характеристики веществ.
Физико-химические процессы сопровождаются выделением (экзо) или поглощением (эндо) энергии в различных формах: тепловой, световой, электрической и механической. 1кал=4,187Дж=4,187*107эрг=0,427кгм. Это дает возможность количественно сопоставлять энергетические эффекты разных реакций.
Тепловой эффект химической реакции – это такое количество теплоты, которое должно быть отведено от продуктов реакции (или сообщено им) для того, чтобы они имели такую же температуру как исходные вещества. Тепловые эффекты изучает термохимия.
Внутренняя энергия
Выделение или поглощение энергии при химических реакциях указывает на то, что все вещества в скрытой форме содержат некоторый запас энергии. Внутренняя энергия обозначается символом – U. Она включает кинетическую энергию всех видов движения и потенциальную – взаимодействия частиц.
U=Eкин+Епот
Абсолютное значение внутренней энергии измерить нельзя, можно определить ее изменение U. U=Uкон-Uнач.
Суммарные внутренние энергии исходных веществ и продуктов реакции разные, что и составляет энергетический эффект.
Внутренняя энергия зависит от:
1 природы и агрегатного состояния веществ, так молярные энергии жидкого и газообразного азота разные, также как азота и кислорода;
2 количества вещества, 1моль или2 моля Н2;
3 температуры – нагревание увеличивает тепловое движение молекул: колебательное, вращательное, поступательное, т.е. Екин;
4 давления – влияет на расстояние между частицами, т.е. на взаимодействие электронов с ядром или Епот.
Уравнение химических реакций, в которых указывается тепловой эффект и агрегатное состояние реагирующих веществ называются термохимическими.
СН4(г)+2О2(г)=СО2(г)+2Н2О(ж)+802кДж
Первое начало термодинамики
Система – вещество или совокупность веществ, которые для изучения мысленно или физически обособляют от окружающей среды.
Энергия может передаваться в двух возможных формах: теплоты Q и работы А.
Постулат: В любом процессе теплота Q, поглощаемая системой, идет на изменение ее внутренней энергии U и на совершение работы против внешних сил А.
Q=U+А
Математическое выражение первого начала термодинамики о сохранении и превращении энергии.
Тепловой эффект зависит от условий проведения реакции при постоянном объеме (изохорно) или постоянном давлении (изобарно).
Изохорно-изотермические реакции проводят в калориметрах, без изменения объема и совершения работы А=0, тогда Q= U.
Следовательно тепловой эффект при постоянном объеме определяется только изменением внутренней энергии.
QV,T=U.
Изобарно-изотермический тепловой эффект. Энтальпия.
Большинство химических реакций протекает в открытых колбах, например
Zn+2HCl=ZnCl2+H2
Выделившийся водород для сохранения давления постоянным, совершает работу против внешних сил по изменению объема, т.е. совершается работа А=Р*V, тогда
QP,T=U+РV
Где U=U2-U1
V=V2-V1
QP,T=U2-U1+P(V2-V1)
QP,T=(U2+PV2) - (U1+PV1)


H2 H1
Обозначив U+PV через Н – энтальпия получим
QP,T=H2-H1=H
H – изменение энтальпии, выражает энергию расширенной системы. Если реакция экзотермическая, то энергия системы убывает QP,T= -H.
Закон Гесса Г.И.
Практически тепловые эффекты определяют колориметром, когда экспериментальное определение невозможно используют термохимические расчеты, основанные на законах термохимии, один из которых сформулирован петербургским химиком Г.И. Гессом в1840 году, который является выражением закона сохранения энергии:
Тепловой эффект реакции не зависит от пути ее протекания, а определяется только природой и состоянием исходных веществ и продуктов реакции.
Из закона Гесса вытекают следствия:
1. Тепловой эффект химической реакции равен разности между суммой теплот образования получающихся веществ и суммой теплот образования вступающих в реакцию веществ (с учетом их стехиометрических коэффициентов)
2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания (сгор) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом их стехиометрических коэффициентов)
Величины стандартных теплот образования и теплот сгорания находят в справочниках. Значение закона Гесса состоит в том, что он позволяет определить тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто, т. е. без побочных процессов.
Энтальпией образования данного сложного вещества называется тепловой эффект реакции образования 1 моля этого вещества из соответствующих простых веществ в устойчивых состояниях.
Стандартная энтальпия образования обозначается символом Н0f,298, размерность ккал/моль, кДж/моль (f – faundeshin-образование).
Энтальпия образования простых веществ равна нулю. Например H2, O2, C, S, Cu, Zn. Энтальпия образования характеризует
1. Прочность химического соединения.
2. Зная энтальпии образования веществ, участвующих в реакции, можно определить тепловой эффект.
Согласно закона Лавуазье-Лапласа энтальпия разложения химического соединения равна по величине и противоположно по знаку энтальпии его образования.
Н0298, обр= -Н0298, разлож.
-
Al2O3
SiO2
SiH4
Н0f,298 кДж/моль
-1676
-905
34,7
Оксиды алюминия и кремния прочные вещества, SiH4 – непрочное, самовоспламеняющееся, реакционноспособное.
Тепловой эффект химической реакции равен разности сумм энтальпий образования продуктов реакции и сумм энтальпий образования исходных веществ этой реакции с учетом стехиометрических коэффициентов. Стандартные энтальпии образования сложных веществ сведены в справочники.
Н0298, х. р.= Н0f,298 прод. -Н0f,298 исх.в-в.
I Cr2O3(к)+2Al(к) = Al2O3(к)+2Cr(к).
II Cr2O3(к)+3Н2(г) = 3Н2О(г)+2Сr(к).
|
-1440,6 |
0 |
-1676,0 |
0 |
Н0f,298 кДж/моль |
-1440,6 |
0 |
-241,8 |
0 |
Н0298, I = -1676-(-1440.6) = -236 кДж
Н0298, II = -(3*241.8) – (-1440.6) = 715 кДж
Первая реакция сопровождается значительным тепловым эффектом, возможна, вторая при стандартных условиях невозможна. Экспериментально установлено, что самопроизвольно протекают экзотермические реакции, принцип Бертло-Томсена.
Na+0.5F2=NaF+574 кДж
Na+0.5Cl2=NaCl+412 кДж
Na+0.5I2=NaI+289 кДж
Чем больше выделяется энергии, тем прочнее образующее соединение, тем полнее идет реакция. Наибольшее сродство натрия к фтору
Энтропия
Самопроизвольное протекание химических реакций не всегда можно объяснить стремлением к минимуму энергии. Так, например, самопроизвольно происходит стремление к беспорядочному движению, расширение веществ диффузия, рассеивание, эндотермические реакции при высоких температурах, обратимые реакции, растворение веществ.
Самопроизвольно происходит смешение двух не взаимодействующих между собой газов без изменения энергии, но с увеличением беспорядка. Самопроизвольное же разделение двух смешанных газов маловероятно.
Самопроизвольно процесс, без изменения энергии, совершается в направлении перехода системы в наиболее вероятное состояние, характеризующееся наибольшим беспорядком. Для количественной характеристики степени беспорядка вводится понятие энтропия – обозначается символом S, размерность S0298 = Дж/моль*К.
![]()
Энтропия зависит от а) природы вещества, б) агрегатного состояния, в) P,V,T – условий проведения реакции.
Все факторы, способствующие увеличению беспорядка в системе, способствуют и росту энтропии, (S0), так же растворение кристаллических веществ, переход жидкости в пар. Наоборот, в процессах конденсации и кристаллизации веществ энтропия уменьшается (S0).
По закону термодинамики Энтропия простого вещества в отличии от энтальпии образования простого вещества не равна нулю.
Направленность процессов. Изобарный потенциал. Энергия Гиббса.
В процессе химических реакций одновременно действуют две тенденции: стремление частиц объединиться в более сложные, что уменьшает энтальпию (Н0) и стремление частиц разъединиться, что увеличивает энтропию (S0).
Суммарный эффект этих двух противоположных тенденций отражает изменение изобарно-изотермического потенциала или энергии Гиббса. G0298=кДж/моль, ккал/моль.
G=H - TS
G0298 образования наиболее устойчивых модификаций простого вещества принимают равной нулю.
Как и в случае Н и S, изменение энергии Гиббса Gх. р. =Gпрод.-Gисх. в-в.
Характер изменения G позволяет судить о принципиальной возможности или невозможности осуществления процесса. При постоянной температуре и давлении реакции могут самопроизвольно протекать только в том направлении, при котором энергия Гиббса системы уменьшается т.е. G0 (-), если G0 (+) реакция при стандартных условиях идет в обратном направлении, при G=0, наступает химическое равновесие, тогда Н=ТS и можно рассчитать равновесную температуру:
![]()
При обычных температурах величина ТS для большинства реакций значительно меньше Н, поэтому на знак и величину G влияет энтальпийный фактор и следовательно экзотермические реакции протекают самопроизвольно, а эндотермические (Н0) вынужденно.
При высоких температурах на величину и знак G оказывает влияние член ТS. Так, реакция горения угля Сграф+СО2=2СО(г) эндотермическая, сопровождается увеличением объема, раз начавшись идет далее самопроизвольно, энергично до конца, т.е. пока не сгорит весь уголь.
Химическая кинетика. Скорость и механизм протекания химических реакций. Закон действующих масс. Правило Вант-Гоффа. Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье. Понятие о катализе.
Химическая термодинамика позволяет судить о принципиальной возможности осуществления химической реакции. Скорость и механизм химических превращений изучает особый раздел химии – химическая кинетика.
Реакции могут быть гомогенные и гетерогенные. Гомогенные реакции протекают в однородной среде, т.е. во всем объеме (например газовая смесь или растворы).
Гетерогенные реакции протекают на границе раздела фаз: твердой и жидкой, газовой и жидкой.
Скорость реакции определяется числом элементарных актов взаимодействия происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций реакции). Скорость реакции обычно характеризуют измерением концентрации реагирующих веществ во времени. Концентрацию в растворе выражают в моль/л, в газах парциальным давлением, время в секундах. Изменение концентрации С=С2-С1 за промежуток времени =2-1 и определит скорость процесса.
![]()
Концентрация реагирующих веществ убывает, знак -, продуктов реакции увеличивается, знак +.
О скорости реакции можно судить по скорости изменения какого-либо свойства системы, например, окраски, электропроводности, спектра, давления, выпадения осадка, выделения газа и др.
Скорость гомогенных химических реакций. Влияние концентрации. Закон действующих масс
Сущность химической реакции заключается в перегруппировке валентных электронов, которая приводит к изменению порядка во взаимосвязи в частицах вновь образовавшегося вещества при этом атомные составы остаются без изменения.
Скорость процесса пропорциональна вероятности столкновения частиц, которая определяется их концентрацией.
Указанная закономерность установлена опытным путем в 1864-67 гг К. Гульдбергом и П. Вааге, в 1865г Н.И. Бекетовым, является основным законом химической кинетики и называется законом действующих масс: при постоянной температуре скорость гомогенных химических реакций прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Так для реакций
I Н2+Cl2=2HCl, V=K*CH2*CCl2
II 2NO+O2=2NO2, V=K*CNO*CO2
К – коэффициент пропорциональности или константа скорости, показывает какая часть от общей концентрации веществ реагирует в данных условиях, определяется природой веществ и изменяется с температурой.
Величина К численно равна скорости реакции, когда концентрации реагирующих веществ равны единице.
Механизм химических реакций
Рассмотрим реакцию окисления бромводорода при 400-6000С описываемую суммарным уравнением
4НBr+O2=2H2O+2Br2
Запишем кинетическое уравнение
![]()
Согласно закона действующих масс, скорость этой реакции должна в значительонй степени зависеть от концентрации бромводорода, чем от концентрации кислорода, в действительности она зависит в равной степени , т.е. V=K*CHBr*CO2.
Если бы эта реакция происходила соответственно суммарному уравнению, то одновременно должны столкнуться 5 частиц, что маловероятно. Экспериментально было установлено протекание процесса через ряд последовательных стадий, которые включают только двойные столкновения.
1 HBr+O2=HOOBr (медленно)
2 HBr+HOOBr=2HOBr (быстро)
3 2HBr+2HOBr=2H2O+2Br2
(быстро)
2HBr+2HOBr=2H2O+2Br2
(быстро)
суммарно 4HBr+O2=2H2O+2Br2
Ряд последовательных простых стадий через которые протекает реакция называются ее механизмом.
Самая медленная стадия механизма определяет скорость суммарного процесса и называется лимитирующей стадией.
Зависимость скорости химической реакции от температуры описывается экспериментально найденным правилом Вант-Гоффа: при увеличении температуры на каждые 100С скорость реакции возрастает в 2-4 раза.
![]()
- температурный коэффициент скорости реакции значение которого лежит в пределах 2-4.
При значении =2 и повышении температуры на 1000С, скорость химической реакции увеличивается в 1024 раза, т.к.

хотя число столкновений при этом возрастает в 1,2 раза.
Таким образом, при повышении температуры на каждые 10 0С число таких молекул возрастает в 2-4 раза.
Энергия активации
Взаимодействие возможно, если сталкивающиеся частицы обладают энергией достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционно способные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера – энергией активации.
Энергия активации – это та энергия, которая необходима для превращения реагирующих веществ в состояние активного комплекса. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости от энергии активации выражается уравнением Аррениуса
К=Z*P*e-Eа/RT
Z – число столкновений молекул в сек в единице объема;
е – основание натурального логарифма;
Р – стерический множитель, учитывающий подходящее расположение молекул в момент столкновения
Из уравнения Аррениуса следует, что константа скорости реакции тем больше, чем меньше энергия активации.
Скорость гетерогенных химических реакций
Многие химические реакции, имеющие большое значение в технике относятся к гетерогенным: горение твердого и жидкого топлива, химическая коррозия металлов, выплавка металлов и многие другие.
Гетерогенные реакции осуществляются на поверхности раздела фаз. Чем больше поверхность, тем больше вероятность столкновения молекул реагирующих веществ, и следовательно скорость зависит не только от концентрации газообразного и жидкого веществ, но и от площади соприкосновения между фазами.
Для реакции горения угля Ств+О2(г)=СО2(г) можно записать V=K*CO2*SCтв.
Поверхность раздела фаз постоянна К*SCтв=К, тогда кинетическое уравнение выражающее закон действующих масс для гетерогенной реакции будет V=K*CO2.
Скорость гетерогенных химических реакций слагается из скорости самой реакции и скорости подвода реагирующих веществ, к границе раздела фаз и отвода от нее продуктов реакции путем диффузии.
Химическое равновесие
Немногие химические реакции протекают в одном направлении, т.е. до полного превращения исходных веществ в продукты реакции. Например:
2КClO3 2KCl+3O2
Б ольшинство
реакций обратимы. Уменьшение концентрации
исходных веществ приводит к увеличению
концентрации продуктов реакции, которые
взаимодействуя между собой образуют
исходные вещества. В обратимых реакциях
знак = заменяется на . Смешение двух
газов СО и NO2
идет с уменьшением окраски, затем
прекращается вследствие сравнивания
скорости прямой и обратной реакции,
т.е. наступления химического равновесия.
ольшинство
реакций обратимы. Уменьшение концентрации
исходных веществ приводит к увеличению
концентрации продуктов реакции, которые
взаимодействуя между собой образуют
исходные вещества. В обратимых реакциях
знак = заменяется на . Смешение двух
газов СО и NO2
идет с уменьшением окраски, затем
прекращается вследствие сравнивания
скорости прямой и обратной реакции,
т.е. наступления химического равновесия.
N
 O2+CO
NO+CO2
O2+CO
NO+CO2
Скорость прямой реакции
![]() .
.
Скорость обратной реакции
![]()
В состоянии химического
равновесия
![]() тогда
тогда
![]()
Поскольку
![]() и
и
![]() при данной температуре постоянны будет
постоянным и их отношение
при данной температуре постоянны будет
постоянным и их отношение
 равновесия
равновесия
Кр – константа равновесия выражает закон действующих масс для процессов, находящихся в состоянии динамического равновесия. Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями.
Д ля гомогенных реакций в газообразной среде, вместо концентраций компонентов удобнее пользоваться величинами соответствующих парциальных давлений. Тогда константа равновесия для реакции аА+вВ mM+nN будет

Р – парциальное давление.
Для реакций в гетерогенных системах с участием твердой и газообразной фаз давление твердой фазы ничтожно и основная его масса не участвует, поскольку взаимодействие протекает только с поверхности. Константу равновесия Кр можно выразить лишь через парциальное давление газообразных веществ, например:
С(тв)+СО2(г)=2СО(г)

Константа равновесия является важной характеристикой химического взаимодействия. Чем больше значение Кр, тем глубже протекает реакция, т.е. тем больше выход ее продуктов, для необратимых реакций Кр к бесконечности. Если К0, то это свидетельствует о практически полном отсутствии взаимодействия. Энергия Гиббса связана с константой равновесия соотношением
G= -RT*lnKp
Смещение химического равновесия. Принцип Ле-Шателье
Состояние химического равновесия зависит от целого ряда факторов: температуры, давления, концентрации и др. Изменение хотя бы одного из этих факторов приводит к смещению химического равновесия.
В системе находящейся в равновесии нельзя изменить концентрацию какого-нибудь из веществ, не вызывая этим изменения концентрации всех остальных.
Состояние равновесия характеризует тот предел до которого в данных условиях реакция протекает самопроизвольно (G0), т.е. без затраты энергии и описывается принципом Ле-Шателье.
Если на систему находящуюся в равновесии оказать воздействие извне, то в системе усиливаются те процессы, которые уменьшают оказанное воздействие
3 H2+N2
2NH3+46,2 кДж
H2+N2
2NH3+46,2 кДж
Синтез NH3 идет полнее, чем ниже температура (Н0), однако при низких температурах процесс достижения равновесия протекает медленно, нужен подогрев, нагревание же приводит к диссоциации аммиака, нагревание можно компенсировать увеличением давления.
Принцип Ле-Шателье применим к системе в истинном химическом равновесии.
Основная литература: [1] – cтр. 115-141, 166-182, 195-200; [2] – стр. 129-136, 166-190; [3] – стр. 35-47, 166-193; [4] – стр. 195-231, 238-259.
Дополнительная литература: [6] – стр. 109-149, [11] – стр. 118–175, [12] – стр. 99-109, [13] – стр. 90-100, [23] – стр. 158-196, [24] – стр. 131-165, [25] – стр. 172-205, 212-216, 229-243.
Контрольные вопросы: [23], стр. 149 – 462.
Сформулируйте I закон термодинамики.
Назовите термодинамические функции состояния и что они характеризуют.
В чем заключается смысл II закона термодинамики?
Назовите критерий самопроизвольного протекания химических реакций в изобарно-изотермических условиях.
Что называется скоростью химических реакций и от каких факторов она зависит?
Сформулируйте закон действующих масс.
Запишите выражения правила Вант-Гоффа и уравнения Аррениуса.
Что такое энергия активации?
Сформулируйте принцип Ле-Шателье.
От каких факторов зависит смещение химического равновесия?
11. Какие реакции называются обратимыми?
2. Что означает состояние химического равновесия? Как можно определить, что в системе наступило равновесие?
38
3. Что определяет константа химического равновесия? От каких факторов она зависит?
4. Напишите математическое выражение закона действующих масс применительно к обратимым идеальным однородным химическим системам и реальным.
5. В каких случаях обратимые реакции протекают до конца? Объясните это с точки зрения закона действующих масс.
Тема лекции 6: Растворы. Способы выражения составов растворов. Свойства растворов неэлектролитов. Осмос, закон Вант-Гоффа.
Растворы электролитов. Теория электролитической диссоциации С. Аррениуса. Сильные и слабые электролиты. Электролитическая диссоциация воды. Водородный и гидроксильный показатели. Произведение растворимости. Реакция нейтрализации.
Гидролиз солей. Константы и степень гидролиза. Влияние температуры и концентрации на степень гидролиза. (2 часа).
Растворами называются взаимодействующие, гомогенные равновесные системы переменного состава из двух и более компонентов. Системой называют компоненты, ограниченные поверхностью раздела от окружающей среды. Например, раствор соли, кислоты, щелочи или другие вещества в стакане, пробирке, колбе. Раствор состоит из 2-х компонентов: растворитель и растворенное вещество. Растворителем считается тот компонент системы, который находится в большем количестве и не меняет своего агрегатного состояния до и после растворения. Например, раствор соли NaCl. Вода – растворитель, NaCl – растворенное вещество. Или 96% этиловый спирт: С2Н5ОН – 96%, Н2О – 4%. Следовательно С2Н5ОН – растворитель, Н2О – растворенное вещество.
Химическая теория растворов была создана Д. И. Менделеевым. Растворение – это химическое взаимодействие растворителя и растворяемого вещества. На химизм процесса указывают следующие признаки:
выделение или поглощение энергии (серная кислота растворяясь выделяет энергию, раствор разогревается);
изменение цвета соли, растворяемой в воде (CuSO4 – белого цвета, CuSO4*5Н2О – голубого);
изменение объема (при растворении 100 мл С2Н5ОН – в 100 мл Н2О, объем меньше 200мл).
Образование раствора идет самопроизвольно и необратимо до устойчивого равновесия. Движущей силой растворения является уменьшение свободной энергии (изобарно-изотермического потенциала) раствора G.
Gпрод -Gисх 0.
Если процесс закончился G=0, наступает равновесие. Энтальпия образования раствора может падать, процесс экзотермический, или возрастать, процесс эндотермический. При образовании растворов изменяется энтропия S, т.е. мера неупорядочности системы. Химическая реакция, протекающая при растворении – это гидратация молекул или ионов, т.е. образование новых гидратированных частиц, когда каждая частица окружена n – количеством молекул Н2О, что приводит к уменьшению концентрации свободных молекул воды. Эти процессы могут быть экзотермическими или эндотермическими.
Выражение состава раствора
Состав раствора можно выражать разными способами:
Массовая доля. Это масса растворенного вещества в %, находящегося в 100г раствора.
Молярность.. Количество вещества (молей) в 1л раствора. Моль – 1л – 1М. 0,1моля – деци, 0,01моля – санти и т.д.
Нормальность – N. Количество эквивалентов растворенного вещества в 1л раствора. Экв. – 1л – 1N р-р.
Моляльность – m. Количество вещества (молей), приходящихся на 1000г Н2О.
Титр раствора. Содержание растворенного вещества (в г) в 1мл раствора. Титр определяется как произведение нормальности на эквивалент:
![]()
Свойства растворов. Осмотическое давление.
При растворении уменьшается концентрация свободных молекул воды, поскольку вода входит в гидратные оболочки растворенных веществ. Если соединить два раствора с разной концентрацией веществ, например сахара, через полупроницаемую перегородку, то в силу разной концентрации будет происходить переток воды из области меньшей концентрации вещества. Этот переток воды обусловлен гидратацией сахара и нехваткой свободной воды в зоне с большей концентрацией. Переток молекул воды через полупроницаемую перегородку называется осмосом, а дополнительное гидростатическое давление на перегородку осмотическим давлением.
Например: возьмем три сосуда с полупроницаемой перегородкой в середине сосуда, чтобы молекулы воды могли свободно проходить через перегородки.
Случай I: концентрации сахара в верхнем и нижнем отделении – одинаковы С1=С2. Столб раствора, давящий сверху-вниз и снизу-вверх на перегородку, одинаков, отвечает состоянию равновесия.

I
Случай II: концентрации разные С1С2. Поскольку концентрация С1С2, то в верхнем отделении сосуда не хватает молекул воды для гидратации, и они начинают перетекать из нижнего отделения в верхнее. Объем раствора в верхнем отделе увеличивается, увеличивается нагрузка на перегородку. И вот это дополнительное гидростатическое давление столба жидкости на перегородку за счет осмоса и есть осмотическое давление.
Случай III: С1С2. Картина обратная случаю II. Дополнительное давление будет происходить снизу-вверх, поскольку в нижнем отделении больший объем.
Чем больше разница концентраций, тем больше осмос, тем больше осмотическое давление. Таким образом, осмотическое давление зависит от концентрации. А кинетическое движение молекул зависит от температуры, чем выше температура, тем выше переток, т.е. осмос. Значит и осмотическое давление зависит от температуры. Эта зависимость носит название закона Вант-Гоффа и имеет вид:
Росм=С*R*T.
Осмотическое давление раствора не электролита прямо пропорционально молярной концентрации и абсолютной температуре.
Понижение давления пара раствора. Первый закон Рауля.
На границе раздела фаз (жидкость-газ) происходят два явления – испарение-конденсация. Молекулы растворителя испаряясь, переходят в газообразную фазу и создают определенное давление водяных паров над растворителем. Конденсируясь в жидкость, пары уменьшают давление. Наконец при определенной температуре (250С или 2980К) наступает равновесие испарение-конденсация и давление водяных паров (т.е. растворителя) будет постоянным. Обозначим его через Р0. Если растворить при той же температуре какой-то нелетучий не электролит (например, сахар), то гидратированные молекулы сахара, распределяясь в объеме и на поверхности раствора, закроют поверхность испарения. И площадь испарения воды уменьшится. Т.е. за тот же промежуток времени и при той же температуре с поверхности раствора испарится меньше молекул воды и давление пара уменьшится. Таким образом, давление пара раствора всегда меньше давления чистого растворителя. Обозначим давление пара раствора через – Р. Разность давлений «Р0-Р», отнесенная к давлению чистого растворителя Р0 – называется относительное понижение давления пара раствора, т.е. –
![]()
Оно зависит от концентрации растворенного вещества, чем его больше, тем больше понижение.
I закон Рауля: для разбавленных растворов не электролитов относительное понижение давления пара раствора равно мольной доле нелетучего растворенного вещества:
![]()
Понижение t0 замерзания и повышение t0 кипения растворов неэлектролитов - II закон Рауля
Вода, как и любой чистый растворитель, имеет температуру кипения и замерзания. Кипит вола при t0=1000С, замерзает при t0=00С, если давление нормальное, т.е. 101325Па. На диаграмме состояния воды – это кривая ОА.

101.325
кПа
00 1000 С
Как это происходит? Когда давление водяных паров становится равным атмосферному, исчезает граница раздела фаз ж-г, и молекулы воды из жидкого состояния свободно переходят в газообразное и наоборот, вода кипит. Если вода охлаждается, процесс конденсации увеличивается, и количество парообразной воды уменьшается, уменьшается и давление водяных паров. Когда давление водяных паров становится ничтожно мало и сравнивается с давлением водяного пара над кубиком льда, вода кристаллизуется. Это происходит при 00С и давлении 4,6мм. рт. ст. водяных паров над кубиком льда. Если растворить в воде нелетучий не электролит, например, сахар, то по I закону Рауля произойдет понижение давления пара растворов. Теперь чтобы достичь атмосферного давления, нужно дополнительно нагреть раствор, и температура повысится. Кривая О1А1. Чем больше концентрация растворенного вещества, тем больше понижение давления пара раствора, тем больше температура кипения раствора. Эта зависимость выражается II законом Рауля и имеет вид:
t0к=Е*m
t0з=к*m,
где t – повышение (понижение) температуры,
Е – эбулиоскопическая (выкипать) константа,
К – криоскопическая (замерзать) константа,
m – моляльная концентрация растворенного вещества.
![]()
где m1 и m2 - масса растворенного вещества и растворителя, М - молярная масса растворенного вещества, 1000 – масса воды.
Закон имеет вид:
![]() (эбулиоскопический метод)
(эбулиоскопический метод)
![]() (криоскопический метод)
Повышение температуры кипения (понижение
температуры замерзания) растворов прямо
пропорционально моляльной концентрации
растворенного вещества. По II
закону Рауля можно определять молекулярные
массы неизвестных веществ.
(криоскопический метод)
Повышение температуры кипения (понижение
температуры замерзания) растворов прямо
пропорционально моляльной концентрации
растворенного вещества. По II
закону Рауля можно определять молекулярные
массы неизвестных веществ.
Законы Вант-Гоффа и Рауля выполняются только для разбавленных растворов неэлектролитов, для которых число молекул (частиц) постоянно в растворе.
Растворы электролитов. Теория электролитической диссоциации С. Аррениуса. Сильные и слабые электролиты. Электролитическая диссоциация воды. Водородный и гидроксильный показатели. Произведение растворимости. Ионный обмен. Реакция нейтрализации.
Электролитами называются вещества, которые в водном растворе или расплаве диссоциируют на ионы и проводят электроток.
Электролиты полностью диссоциирующие на ионы (нацело) называются сильными, неполностью (частично) диссоциирующие – средние или слабые. К электролитам относятся растворы кислот, оснований и солей. При диссоциации образуются катионы, положительно заряженные и анионы отрицательно заряженные ионы. Например:
НСl=H++Cl-
NaOH=Na++OH-
AgNO3=Ag++NO3-.
Все ионы в растворе гидратированы, но для простоты и удобства гидратные оболочки не пишут.
В растворах сильных электролитов нет молекул, присутствуют только ионы. В растворах слабых электролитов в равновесии находятся ионы со своими молекулами, поэтому процесс диссоциации обратимый, равновесный ступенчатый. Например:
1. диссоциация угольной кислоты
Н
 2СО3
Н++НСО3-1.
2СО3
Н++НСО3-1.
2. диссоциация гидроксида меди
С u(ОН)2 СuOH++OH-.
При ступенчатой диссоциации слабых многоосновных кислот и оснований образуются промежуточные гидро-анионы и гидроксо-катионы.
Силу электролита определяют по электропроводности:
![]()
где v – эквивалентная электропроводность вещества при данном разведении, - электропроводность при бесконечном разведении (v).
Поскольку электропроводность связана с количеством ионов, то степень диссоциации можно определить как отношение распавшихся молекул к общему количеству молекул:
![]()
«» можно выражать в долях единицы или в процентах. При бесконечном разведении «» стремится к 1 или 100%.
Слабые электролиты диссоциируют обратимо, т.е. ионы находятся в равновесии со своими молекулами. Поэтому для таких реакций можно написать константу равновесия, которая будет называться константой диссоциации. Например:
Н 2СО3
Н++НСО3-1( 1 ступень).
2СО3
Н++НСО3-1( 1 ступень).

H CO3- H++CO3-2
 (2 ступень)
(2 ступень)
Чем меньше константа диссоциации, тем слабее электролит. Подобные константы выведены для слаборастворимых, но малодиссоциирующих электролитов. Для электролитов выпадающих в осадок, т.е. малорастворимых соединений, существует другая измерительная величина, называемая призведением растворимости – ПР. Например:
AgCl Ag++Cl-
![]()
Но концентрация AgCl в осадке уже не меняется, поэтому можно ее перенести в левую сторону равенства, как постоянную величину, т.е.
К*AgCl=Ag+Cl-, K*AgCl=ПР.
Т.е. ПР=Ag+Cl-.
«ПР» как и «К» даны в таблицах учебников и задачников.
Знание силы электролита важно для правильного написания химических реакций – ионных и гидролиза. В зависимости от силы электролита реакция протекает до конца – необратимые реакции, или протекает необратимо, т.е. до конца не доходит. Существует несколько случаев необратимых реакций:
образование слабого электролита воды, реакция нейтрализации
2NaOH+H2SO4=Na2SO4+2H2O
2Na++2OH-+2H++SO4-2=2Na++SO4-2+2H2O. K=1.8*10-16
2OH-+2H+=2H2O
вытеснение слабой кислоты сильной кислотой
K2CO3+2HCl=2KCl+H2CO3. K1=4.5*10-7
2K++CO3-2+2H++2Cl-=2K++2Cl-+H2CO3
CO3-2+2H+=H2CO3-
вытеснение слабого основания сильным основанием
CuSO4+2KOH=Cu(OH)2+K2SO4
Cu+2+SO4-2+2K++2OH-=Cu(OH)2+2K++SO4-2
ПР=2,2*10-20
Cu+2+2OH-=Cu(OH)2
образование газообразного вещества, удаляющегося из реакции
(NH4)2S+2HBr =2NH4Br +H2S(г). К1=8,9*10-8
2NH4++S-2+2H++2Br- =2NH4++2Br- +H2S
S-2+2H+=H2S
выпадение осадка труднорастворимой соли.
BaCl2+Na2SO4=BaSO4+2NaCl
ПР=1,1*10-10
Ba+2+2Cl-+2Na++SO4-2=BaSO4+2Na++2Cl-
Ba+2+SO4-2=BaSO4
образование комплексного соединения, константа нестойкости которого меньше константы диссоциации или ПР.
HgI2+2KI=K2HgI4
ПР=1,1*10-11 Кн=1,3*10-30
HgI2+2K++2I-=2K++HgI4-2
HgI2-+2I-=HgI4-2
Как пример обратимого процесса, где реакция как таковая не идет:
CuSO4+2KNO3=Cu(NO3)2+K2SO4
Cu+2+SO4-2+2K++2NO3-=Cu+2+NO3-+2K++SO4-2
Все вещества сильные электролиты, существуют только в виде своих ионов, т.е. процесса нет.
Для практики написания химических реакций нужно знать какие вещества сильные электролиты, какие нет. Для консультации существуют справочники, но и знание общих закономерностей облегчает задачу.
Ионное произведение воды и рН растворов
Вода – один из слабых электролитов. Константа диссоциации равна 1,8*10-16.
Н2О Н++ОН-
![]() (1)
(1)
Возьмем 1л Н2О. Плотность Н2О при 250С равна 1г/см3. Таким образом масса 1л Н2О будет равна 1000г: m=d*V=1г/см3*1000см3=1000г.
Молярная концентрация
![]()
Подставим значение в формулу (1), получим
![]() (2) откуда, перемножив постоянные, получим
(2) откуда, перемножив постоянные, получим
Н+ОН-=1,8*10-16*55,55=1,0*10-14, т.е.
(3) Н+ОН-=1,0*10-14 – ионное произведение воды.
Так как Н+=ОН-=1,0*10-14=1,0*10-7.
Т.е. Н+=ОН-=1,0*10-7 – нейтральная реакция.
Если Н+ОН-, то реакция среды кислая.
Если Н+ОН-, то реакция среды щелочная.
Реакция может меняться в пределах ионного произведения воды от 10-1 до 10-14.
(4) 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
 кислая Н
щелочная
кислая Н
щелочная
Для определения среды пользуются водородным показателем рН= -lgН+. Тогда шкала (4) преобразуется в шкалу степеней с положительным знаком (5).
( 5)
1,2,3,4,5,6, 7, 8,9,10,11,12,13,14.
5)
1,2,3,4,5,6, 7, 8,9,10,11,12,13,14.
к Н щ
Например, Н+=10-4, тогда рН- -lgН+= -lg10-4=4.
Задача: Найти ОН-, если рН=5.
Н+ ОН-=10-14.
РН=5. Н+=10-5
![]()
рН+рОН=14
рОН=14-5=9
ОН-=10-9
Гидролиз солей. Константы и степень гидролиза. Влияние температуры и концентрации на степень гидролиза.
Гидролизом солей называется взаимодействие растворенных частей соли с ионами воды, в результате чего образуются новые слабые электролиты и меняется рН среды. В зависимости от состава соли, гидролиз может протекать по нескольким схемам.
Состав соли может зависеть от силы кислоты и основания (гидроксида). В зависимости от их сочетаний образуется четыре состава соли:
Сильная кислота |
Сильное основание |
HNO3 |
KOH |
|
NaOH |
H2SO4 |
Ba(OH)2 |
Слабая кислота |
Слабое основание |
H2CO3 |
NH4OH |
|
Cu(OH)2 |
HCNS |
Fe(OH)3 |
Соль, образованная сильной кислотой и сильным основанием.
KNO3+HOH=KOH+HNO3. Ионная реакция имеет вид:
K++NO3- +HOH=K++OH-+H++NO3-
HOH=OH-+H+=HOH. Процесса нет.
Соль, образованная сильным катионом и анионом, гидролизу не подвергается.
Соль сильной кислоты и слабого основания.
NH4Cl+HOH=NH4OH+HCl 1.8*10-5
NH4++Cl-+HOH=NH4OH+H++Cl-
NH4++HOH=NH4OH+H+. pH7.
Гидролизу подвергается слабый катион, реакция среды кислая, поскольку образуется сильная кислота. Если слабый катион двух-трех -зарядный, то промежуточный продукт основная соль:
СuCl2+HOH=CuOHCl+HCl. Гидролиз протекает ступенчато.
Cu+2+2Cl-+HOH=CuOH++Cl-+H++Cl-
Cu+2+HOH=CuOH++H+. pH7.
Слабый катион образует промежуточный гидроксокатион.
Соль сильного основания и слабой кислоты.
K 2CO3+HOH=KOH+KHCO3
2K++CO3-2+HOH=K++OH-+K++HCO3-. K1=7.5*10-7
CO3-2+HOH=OH- +HCO3- K2=7.8*10-11
pH7
Поскольку анион НСО3- имеет константу диссоциации в 10000 меньшую (4,8*10-114,5*10-7), то в первую очередь образуется гидроанион, а не молекула Н2СО3. Процесс ступенчатый, постепенный, рН7, реакция среды щелочная, образуется сильная щелочь.
Соль слабого основания и слабой кислоты.
N H4CN+HOH NH4OH+HCN
1.8*10-5 4.9*10-13
NH4++CN-+HOH=NH4OH+HCN. pH7
Реакция среды нейтральная, поскольку образуются два слабых электролита.
Конечный совместный гидролиз двух солей, если их продукт не существует в водной среде. В таблице растворимости стоит прочерк.
2AlCl3+3Na2CO3+6HOH=2Al(OH)3+3H2CO3+6NaCl.
Т.е. карбонат алюминия в воде не существует, он подвергается сразу в одну ступень гидролизу, давая слабые электролиты.
2Al+3+6Cl-+6Na++3CO3-2 +6HOH=2Al(OH)3+3H2O+3CO2+6Na++6Cl
2Al+3+3CO3-2 +3HOH=2Al(OH)3+3CO2 pH7.
Реакции гидролиза подвергаются практически все соли, кроме 1 случая, поэтому умение писать реакции правильно, даст возможность понимать химическую суть протекающих процессов.
Основная литература: [1] – стр. 204-238; [2] – стр. 191-229; [3] – стр. 194-223; [4] – стр. 125-183.
Дополнительная литература: [6] – стр. 109-149, [11] – стр. 176-216, [12] – стр. 256-261, 283-288, [13] – стр. 100-123, 139-140, [23] – стр. 197-214, 243-263, [24] – стр. 234-248, [25] – стр. 262-276, 283-288.
Контрольные вопросы:
Сформулируйте понятие «раствор». Что такое растворитель?
Назовите способы выражения состава растворов.
Что выражают молярная и эквивалентная концентрации?
Сформулируйте I и II законы Рауля.
Что называется осмосом? От чего зависит осмотическое давление?
Дайте определение электролитов.
Назовите сильные и слабые электролиты. Как они различаются по степени диссоциации?
Что характеризуют константа диссоциации и произведение растворимости?
В каких случаях ионообменные реакции идут до конца?
Чему равно ионное произведение воды? Что называется рН?
Сформулируйте понятие «гидролиз солей». Какие соли по составу могут подвергаться гидролизу?
Что такое степень гидролиза? От каких факторов она зависит?
Тема лекции 7: Окислительно-восстановительные реакции. Степень окисления. Окисление и восстановление. Типы ОВР. Методы: электронного баланса, полуреакций.
Электрохимические процессы. Электродные потенциалы и электродвижущие силы. Водородный полуэлемент. Электрохимический ряд металлов. Гальванические элементы.
Электролиз. Законы электролиза. Электролиз расплавов и растворов электролитов. Выход по току. (2 часа).
Окислительно-восстановительные реакции (ОВР) – это реакции в которых происходит изменение степеней окисления за счет передачи электронов от восстановителя к окислителю.
Степень окисления – это условный заряд атома в молекуле, если предположить, что атомы состоят только из ионов.
Степень окисления меняется от низшей (-4) через 0 до высшей (+8) в зависимости от положения элемента в таблице Д. И. Менделеева. Например:
C-4 N-3 S-2 Cl- H0 K+ Mn+2 Cr+3 Mn+4 N+5 S+6 Mn+7 Os+8
СН4, NH3, H2S, HCl, H2, KCl, MnSO4, Cr2O3, MnO2, HNO3, H2SO4, HMnO4, OsO4.
Существуют элементы с постоянной (не меняющейся)степенью окисленности в ионном состоянии. Это элементы I, II и III групп таблицы Менделеева – Н+, Са+2, Аl+3. Элементы других групп имеют меняющиеся степени окисления и могут иметь целый ряд степеней окисления. Например, Mn. Электронная формула Mn имеет вид:25Mn 1S22S2p63S2p64S23d5. Валентные электроны 4S23d5 в ячейках дают
5 одиночных «е» в нормальном положении и 7 одиночных «е» при возбуждении.
|
|
|
|
|
↑↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
|
|
|
|
|
|
↓ |
↓ |
|
|
↓ |
↓ |
↓ |
↓ |
↓ |
|
|
|
|
Т.е. Мn имеет следующие соединения:
Мn0 |
Мn+2 |
Mn+4 |
Mn+6 |
Mn+7 |
|
MnO |
MnO2 |
MnO3 |
Mn2O7 |
|
Mn(OH)2 |
|
H2MnO4 |
HMnO4 |
|
MnSO4 |
|
K2MnO4 |
KMnO4 |
Степень окисления находится как алгебраическая сумма зарядов, приравненных к нулю. Например:
H2S |
+1*2+X=0 |
X=-2 |
S-2 |
H2SO3 |
+1*2+X-2*3=0 |
Х=6-2=4 |
S+4 |
H2SO4 |
1*2+X-2*4=0 |
Х=8-2=+6 |
S+6 |
П роцессом
окисления называется процесс отдачи
или оттягивания «е» от атома, иона или
молекулы, при этом партнер, отдающий
«е» называется восстановителем. Например:
роцессом
окисления называется процесс отдачи
или оттягивания «е» от атома, иона или
молекулы, при этом партнер, отдающий
«е» называется восстановителем. Например:
Zn-2e=Zn+2 Zn
S-2-6e=S+4 S-2 восстановители
Окислитель в процессе реакции восстанавливается, а восстановитель окисляется.
При окислении степень окисления повышается. Процессом восстановления называется процесс принятия или притягивания “е” атомом, ионом или молекулой, при этом партнер называется окислителем. Например:
M n+7+5e=Mn+2
Mn+7,
Fe+3 –
окислители.
n+7+5e=Mn+2
Mn+7,
Fe+3 –
окислители.
Fe+3+e=Fe+2
При восстановлении степень окисления понижается.
В качестве окислителей могут выступать такие вещества, которые легко присоединяют “е”, имея на внешнем энергетическом валентном уровне 7 “е”(галогены) или пустые квантовые ячейки, проявляя при этом максимальную положительную степень окисления. Например:
17Сl 3S2p5
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ |
Mn+7 в анион MnO4-…4S03d0
S+6 -||- SO4-2…3S0p0
Эти ионы только восстанавливаются, являясь однозначными окислителями.
Восстановителями могут быть вещества легко отдающие валентные «е» (1,2,3). Это металлы, на внешнем электронном уровне которых находится 1,2,3 электрона.
11Na 1S22S2p63S1
12Mg -||- 3S2
↑↓ |
↓ |
↓ |
↓ |
|
|
13Al -||- 3S2p1
↑↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
|
Na0-e=Na+, Mg-2e=Mg+2, Al0-3e=Al+3
Восстановителями могут быть отрицательно заряженные неметаллы, отдающие ранее принятые электроны:
2N-3-6e=N20, S-2-2e=S0, S-2-6e=S+4
S-2-8e=S+6, 2O-2-4e=O20, 2Cl—2e=Cl2, и.т.д.
Эти вещества могут только отдавать электроны, т.е. окисляться, являясь однозначными восстановителями.
Ионы с промежуточной степенью окисленности могут обладать окислительно-восстановительной двойственностью, т.е. быть и окислителями и восстановителями. Поведение им диктует партнер, являющийся однозначным окислителем или восстановителем. Например:
M n+7+5e=Mn+2 окислитель
S +4-2e=S+6 восстановитель
S-2-2e=S0 восстановитель
S+4+4e=S0 окислитель
ОВР может протекать в трех средах – кислой, нейтральной и щелочной, т.е. при 7≤рН>7. Для правильного написания продуктов реакции необходимо знать химические свойства элементов и сложных веществ, а также некоторые правила, которые называются правилами стяжения.
Правила стяжения
1 Если при ОВР образуется катион металла со степенью окисления Ме+1, Ме+2, Ме+3, то при рН<7 они образуют нормальные соли. Например, К2SO4, MnSO4, Cr2(SO4)3.
2 Если при ОВР образуется элемент со степенью окисления +4 (Э+4), то при рН=7 (нейтральная среда), образуются диоксиды. Например: SO2, MnO2, PbO2 …
3 Если образуются амфотерные катионы со степенью окисления Ме+2, Ме+3, то при рН>7 они образуют гидроксокомплексы. Например: [Zn(OH)4]-2, [Cr(OH)6]-3.
4 Если в результате ОВР образуются ионы со степенью окисления Э+5, Э+6, Э+7, то независимо от рН, они стягиваясь с кислородом образуют анионы высших кислот. Например:
N+5 – NO3-, Cr+6→CrO4-2(pH>7), Cr2O7-2(pH<7), S+6 – SO4-2, Mn+7 – MnO4-
5 Если ОВР протекает при 7>рН>7(т.е. в кислой и щелочной средах), обязательным продуктом будет вода – Н2О. Если ОВР протекает при рН=7, то образуются ионы ОН-.
6 Если баланс атомов по О-2 и Н+ не сходится, то можно вводить дополнительно:
при рН≤7 – воду
при рН>7 – ОН-(щелочь).
7 Должен соблюдаться баланс электронов, который достигается нахождением коэффициентов из общего кратного принятых и отданных «е», а также баланс атомов на основании закона сохранения масс.
Пример составления ОВР.
К2Сr2O7+KNO2+H2SO4(p)=
H2SO4(p) всегда выступает в качестве среды и в процессе ОВР участия не принимает.
Определяем окислитель и восстановитель. Ими являются Сr и N;
Определяем их степени окисления:
K2Cr2O7 KNO2
+1*2+2X-2*7=0 1+X-2*2=0
2X=14-2 X=+4-1
2X=12 X=+3
X=6 N+3.
Cr+6
Cr+6 имея высшую положительную степень окисления (стоит в VI группе таблицы Менделеева) может быть только окислителем, т.е. восстанавливается. N+3 обладает окислительно-восстановительной двойственностью, но в данном случае он восстановитель, т.е. окисляется.
До какой степени окисленности могут восстанавливаться и окисляться партнеры видно из строения электронных оболочек этих атомов и соединений, которые соответствуют этим степеням окисления.
24Сr 1S22S2p63S2p64S13d5
↓ |
↓ |
↓ |
↓ |
↓ |
-3e
в
 осстановитель
Cr+3
Cr+6
окислитель
осстановитель
Cr+3
Cr+6
окислитель
 +3e
+3e
Cr2O3 Cr2O3 CrO3


Cr(OH)3 HCrO2 H2CrO4 H2Cr2O7
Cr2(SO4)3 KCrO2 K2CrO4(pH>7) K2Cr2O7(pH<7)
pH<7 pH>7
7N 1S22S2p3
↑↓ |
↓ |
↓ |
↓ |
восстановитель N-3 N0 N+1 N+2 N+3 N+4 N+5 окислитель
 NH3
N2
N2O
NO N2O3
NO2
N2O5
NH3
N2
N2O
NO N2O3
NO2
N2O5
HNO2 HNO3
KNO2 КNO3
(HNO2+HNO3)
Таким образом, Сr+6 только окислитель, принимающий 3 «е», но посколько в молекуле K2Cr2O7 два Сr+6, то в сумме принято 6 «е». Азот N+3 в данном случае отдает 2”е”, переходя в N+5, минуя степень окисления N+4, потому что N+4 соответствует двум кислотам поровну, он дает сложный оксид 4NO2=N2O3+N2O5=N4O8, и в данной реакции не образуется.
Т.е. электронный процесс имеет вид:
2 Сr+6+2*3e=2Cr+3
N+3-2e=N+5 3
Количество принятых «е» равно 6, а отданных «е» - 2. Наименьшее кратное 6, коэффициент для азота равен 6/2=3. Написание продуктов реакции строго по правилам:
Сr+3 при рН<7 дает нормальную соль – Сr2(SO4)3
N+5 образует стягиваясь с кислородом анион высшей кислоты NO3-, а продуктом будет соль KNO3
K+ из K2Cr2O7, который разрушился, также даст при рН<7 нормальную соль с анионом SO4-2 – K2SO4
При рН<7 кислород из K2Cr2O7 и водород из H2SO4 дают Н2О.
Таким образом, K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
Найденный коэффициент 3 проставляется перед КNO2 и KNO3, в остальном реакция уравнивается по закону Ломоносова, т.е. балансу атомов.
Вышеописанный метод называется методом электронного баланса. Но он неточен, ибо неправильно отображает форму существования ионов. Нет иона Cr+6,а есть анион Сr2O72-, нет N+3, а есть анион NO2-. Поэтому существует другой метод составления ОВР – метод электронно-ионного баланса или метод полуреакций.
K2Cr2O7+3KNO2+4H2SO4(p) = Cr2(SO4)3+3KNO3+K2SO4+4H2O
Попробуем уравнять эту уже известную реакцию методом ионного баланса.
1) Cr2O72- →2Cr3+.
Метод сводится к балансу атомов в левой и правой частях уравнения. Поскольку ОВР протекает при рН<7, можно пользоваться водой, вводя в правую часть 7 молей воды по количеству кислорода в левой части.
C r2O72-+14Н++6е→2Сr3++7Н2О
r2O72-+14Н++6е→2Сr3++7Н2О
+12 +6
В правой части появилось 14Н+, которые для баланса нужно ввести в левую часть уравнения. Затем свести баланс зарядов.
2
 )
NO2-+H2O-2e→NO3-+2H+
)
NO2-+H2O-2e→NO3-+2H+
- +
Во втором уравнении недостающий кислород в левой части вводится также при помощи Н2О, а в правую часть плюсуется 2Н+, баланс зарядов (-2е).
Напишем эти уравнения рядом и найдем коэффициент для баланса отданных и принятых «е».
Cr2O72-+14Н++6е=2Сr3++7Н2О
3 NO2-+H2O-2e=NO3-+2H+
Умножая на коэффициент 3, сложим два уравнения в одно, сокращая «+6е» и «-6е»:
Cr2O72-
+14Н++3NO2-+3H2O
=2Cr+3+7H2O+
3NO3-
+6H+
8 4 3K+
2K+ 4SO42- 3K+ 3SO42- 2K++SO42-
Вводим недостающие катионы K+ и анионы SO42-, получаем полное уравнение.
K2Cr2O7+4H2SO4+3KNO2=Cr2(SO4)3+4H2O+3KNO3+K2SO4
Преимущества ионного баланса:
правильная запись формы ионов (не Сr+6, а Cr2О7-2);
правильное местонахождение воды;
сразу прописываются коэффициенты перед формулами веществ.
Электрохимические процессы. Электродные потенциалы и электродвижущие силы. Водородный полуэлемент. Электрохимический ряд металлов. Гальванические элементы.
Металлические элементы, кроме ртути, имеют кристаллическое строение. В узлах кристаллической решетки находятся атомы или ионы металлов. Если опустить пластину металла в воду, которая является полярным растворителем, то металлическая пластина будет терять электроны с поверхности. Это произойдет за счет кулоновских сил притяжения между катионом металла и диполем воды, ориентированным своим отрицательным концом к пластине. Катионы металла уходят в воду, а на пластине остаются электроны. Электроны выстраиваются в моноэлектронный слой и пластина заряжается отрицательно. К поверхности пластины притягиваются положительно заряженные гидратированные катионы металла, также образующие моноионный слой.
Z n0-2е=Zn+2+H2O Zn(H2O)n2+
На границе раздела фаз электрод – раствор образуется двойной электрический слой – возникает скачок потенциала . Если воду заменить на 1М раствор соли металла (например ZnSO4), то растворение металла будет строго определенным и скачок потенциала также постоянным, если соблюдается постоянство всех остальных параметров (m,t0). Возникающий на границе раздела фаз в 1М растворе скачок потенциала будет называться нормальным электродным потенциалом металла 0. Были измерены потенциалы всех металлов и построен электрохимический ряд активности металлов – ряд напряжения. Начинают этот ряд щелочные металлы, как самые активные. Металлы с отрицательным и положительным значением потенциала разделены водородом, потенциал которого принят за нуль.
Li |
Rb |
K |
Cs |
Ba |
Ca |
Na |
Mg |
Al |
Mn |
- 3.045 |
- 2.925 |
-2.925 |
-2.923 |
-2.90 |
-2.87 |
-2.71 |
-2.37 |
- 1.7 |
-1.18 |
Zn |
Cr |
Fe |
Cd |
Co |
Ni |
Sn |
Pb |
H |
Cu |
-0.76 |
-0.74 |
-0.44 |
-0.40 |
-0.28 |
- 0.25 |
-0.14 |
-0.13 |
0 |
+0.34 |
Ag |
Hg |
Au |
|
|
|
|
|
|
|
+0.80 |
+0.85 |
+1.50 |
|
|
|
|
|
|
|
Из ряда напряжения вытекает два следствия: 1) металлы, стоящие до водорода, вытесняют водород из кислот-неокислителей; 2) металлы вышестоящие (левее) вытесняют металлы ниже стоящие (правее) из солей.
1) Zn+2HCl=ZnCl2+H2
2) Cd+CuSO4=CdSO4+Cu.
Д ля измерения электродного потенциала пользуются водородным полуэлементом. Полуэлемент – система состоящая из электрода (металлическая пластина) и раствора электролита.

H2

1М H2SO4
Водородный полуэлемент, состоит из черненной платины (прессованный порошок платины, нанесенный на гладкую платину), имеющей огромное количество пор, и элементарного газообразного водорода, абсорбированного порами порошка платины. Все это опускается в раствор 1М Н2SO4, диссоциированной на ионы – Н2SO4=2H++SO4-2. Молекулярный водород, соприкасаясь с Pt, диссоциирует на атомы, и в растворе на границе раздела фаз газ-жидкость, возникает скачок потенциала 2Н/2Н+, измерить который невозможно, поэтому он был принят за Н20=0,00В. По отношению к нулевому водородному потенциалу были измерены потенциалы металлов и эта разность потенциалов была принята за потенциал металла.
Теория гальванических элементов
Система, состоящая из двух полуэлементов, называется гальваническим элементом. В гальваническом элементе один электрод растворяется, на другом восстанавливаются катионы металлов или водорода. Например:

Zn0 Zn+2 Cu+2 Cu0
Потенциал Zn EZn0= -0.76B, потенциал Cu ECu0= +0.34B. Поскольку у Zn-электрода более отрицательный потенциал, цинк более активный будет растворяться, и электроны от цинковой пластины будут перетекать через проводник первого рода и измерительный прибор ко второму медному электроду, на котором восстанавливаются катионы меди (рис 3).
Zn KCl
1M
ZnSO4
Cu
1M
CuSO4




Х имизм процесса: I II
Zn0-2e=Zn2+, восстановитель.
Cu2++2e=Cu0, окислитель.
Эдс – электродвижущая сила гальванического элемента, т.е. разность потенциалов находится как эдс=Ео-Ев, эдс – всегда положительная величина. Таким образом,
эдс=ECu0 – EZn0 =+0.34-(-0.76)=1.1B.
В первом сосуде растворение цинка ограничивается концентрацией ионов Zn2+ в растворе, при достаточно большой концентрации раствор зарядится положительно и процесс прекратится – положительная поляризация. Во втором сосуде получается со временем избыток атомов SO42-, поскольку катионы меди восстанавливаются – наступает отрицательная поляризация и процесс также прекращается. Для снятия «+» и «-» поляризации оба сосуда соединяются U-образной трубкой для перетока аниона из II сосуда в I, наступает равновесие ионов и процесс продолжается.
Если концентрация солей отличается от 1М, тогда потенциалы электродов подсчитываются по формуле Нернста, которая имеет вид:
![]()
Подставив значения постоянных R,T,F, и пересчитав ln=2.303lg, имеем формулу:
![]()
где n – валентность металла или число электронов.
Задача: Найти эдс системы Fe/Fe2+(10-3моль/л) // Sn2+(10-1моль/л) / Sn.
Найдем потенциал железа и олова по формуле Нернста:
![]()
![]()
эдс=ЕSn-ЕFe=-0.169-(-0.527)=+0.358B
Гальванические элементы – это химические источники тока. Они продуцируют электроток за счет химических реакций окисления-восстановления. Эти реакции называются электрохимическими.
Электролиз. Законы электролиза. Электролиз расплавов и растворов электролитов. Выход по току.
В процессах электролиза обратная картина: окислительно-восстановительные реакции протекают за счет внешнего тока. Таким образом электролиз – это окислительно-восстановительный процесс, проходящий на электродах при прохождении электротока через электролит. Для электролиза необходим электролизер (любой формы – стакан, колба, U – трубка и т.д.) и электроды. Электродами могут служить прессованные графитовые стержни, которые только переносят электроны, сами не участвуют в процессе, т.е. индифферентные; и металлические стержни, участвующие в процессе анодного растворения. Электролитом могут быть водные растворы и расплавы солей. В зависимости от природы электролита и материала электрода различают три типа электролиза: 1) электролиз водного раствора на индифферентных электродах, 2) электролиз с растворимым анодом, т.е. рафинирование – очистка металлов.
I тип – электролиз водных растворов на угольных стержнях
В этом типе электролиза различают четыре случая протекания процесса, который зависит от потенциала металла (катиона) и природы и потенциала аниона. Следует учитывать последовательность разряда ионов. Разряд ионов происходит на катоде – отрицательном электроде и на аноде – положительном электроде. На катоде разряжаются катионы (поэтому называется катодом), а на аноде анионы.

-
K
На катоде будут разряжаться, т.е. катодно восстанавливаться, те катионы, электродный потенциал которых положительный. Это катионы заканчивающие ряд напряжения металлов:
Au3+ |
Hg2+ |
Ag+ |
Cu2+ |
H+ |
+1.5 |
+0.85 |
0.80 |
+0.34 |
0 |
Катионы металлов, начинающие ряд напряжения, никогда не разряжаются в водной среде, потому что конкурирующим катионом будет катион Н+, имеющий нулевой или небольшой отрицательный потенциал. Т.е. металлы от Li до Al включительно не разряжаются в водной среде:
-
Li+
Rb+
…
Al3+
-3.045
-2.925
-1.7

H+(EH20=0.0B или Е0Н2 рН=7= -0,41В).
Потенциал водорода при рН=7 можно подсчитать, он будет иметь значение по формуле Нернста:
![]()
Таким образом электродный потенциал средних металлов от Zn до Pb, сравним с потенциалом водорода при рН7, поэтому эти металлы будут разряжаться совместно с водородом.
Анодное окисление также имеет свою последовательность разряда. Чем отрицательнее потенциал, тем труднее разряжаются анионы. Например, последовательность разряда анионов в зависимости от потенциала такова:
-
Ион
S2-
2I-
2Br-
2Cl-
2O2-
2F-
Еокисл
+0.506
-0.534
-1.086
-1.958
-1.229
-2.85
Кислородсодержащие анионы: SO42-, NO3-, PO43-, CO32- и т.д. никогда не разряжаются в водной среде вместо них идет разряд О-2 из воды. Потенциал разряда Н2О:
П роцесс восстановления Евосс= -0,828В 2Н2О+2е=Н2+2ОН-
Процесс окисления Еок = -1,229В 2Н2О –4е=О2+4Н+
а) Электролиз раствора CuSO4.
Диссоциация CuSO4=Cu2++SO42-.
Диссоциация Н2О=Н++ОН-.
Катодный процесс (-) Cu2++2e=Cu0. Анодный процесс (+) SO42- не разряжает
Н+ 2Н2О-4е=О20+4Н+

в электролизере: 2Н++SO42-=H2SO4
в) Электролиз AuCl3 – золочение предметов.
Диссоциация AuCl3=Au3++3Cl-.
Диссоциация Н2О=Н++ОН-.
(-) Au3++3e=Au0. (+)2Cl- -2e=Cl20.
H+ OH-
 В электролизере:
Н++ОН-=Н2О
В электролизере:
Н++ОН-=Н2О
с) Электролиз KBr – промышленный способ получения щелочей.
Диссоциация KBr=K++Br-.
H2O=H++OH-
(-) К+ не восст. (+) Br-.
2H++2e=H2 OH-
2H2O+2e=H2+2OH- 2Br- -2e=Br20.

В электролизере К++ОН-=КОН
д) Раствор соли Na2SO4 – промышленный способ получения Н2.
Диссоциация Na2SO4=2Na++SO42-
H2O=H++OH-
K(-) 2Na+ не разр. (+) SO4-2 не разр.
2Н++2е=Н2 2ОН- -2е=Н2О+О
 2Н2О+2е=Н2+2ОН-
2Н2О-4е=О2+4Н+
2Н2О+2е=Н2+2ОН-
2Н2О-4е=О2+4Н+
в электролизере 2Na++SO42-=Na2SO4
Таким образом, при электролизе водных растворов на угольном стержне возможны четыре случая протекания электролиза, при котором могут образовываться кислота, вода, щелочь или соль.
II тип – электролиз расплавов
Расплав – это жидкое агрегатное состояние соли, получаемое при нагревании соли (без воды). В расплаве соль, также как и в растворе, диссоциирована на ионы.
Электролиз расплава протекает при высоких напряжениях, поскольку конкурирующих катионов воды нет.
Электролиз соли NaCl – промышленный способ получения щелочных металлов.
NaCl=Na++Cl-
(-) 2Na++2e=2Na0 (+)2Cl- -2e=Cl20
III тип – электролиз с растворимым анодом – очистка, рафинирование металлов
В этом типе электролиза используется растворимый анод, содержащий примеси других металлов. Растворение анода и восстановление на катоде происходит при строго контролируемом потенциале, поэтому металл анода и примеси переходят в раствор, но восстанавливается на катоде только основной металл. Так происходит очистка металлов от примесей. Например: рафинирование меди.
+
CuSO4
 -
-
На аноде загрязненная болванка черновой меди, она окисляется:
(+) Cu0-2e=Cu2+
(-) Cu2++2e=Cu0
На катоде только катионы меди восстанавливаются. Примеси остаются в растворе.
Законы Фарадея
I закон. Массы веществ, выделившихся на электроде при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит:
m=I*
m – масса в граммах,
I – сила тока в А,
- время в сек.
II закон. Одинаковые количества электричества выделяют при электролизе эквивалентные массы различных веществ.
![]()
А – атомная масса,
n – количество «е», т.е. его зарядность в соединении,
F – число Фарадея=96500Кл.
Коррозия металлов – это разрушение (окисление) металлов от воздействий окружающей среды. Среда, в которой могут находиться металлы или металлические конструкции, может быть воздушной, электролит, почва или электроток, действующий на металл. В зависимости от среды различают несколько видов коррозии:
Химическая или газовая;
Электрохимическая;
Почвенная;
Коррозия от блуждающих токов (в почве).
Химическая или газовая коррозия протекает на воздухе. Состав воздуха таков: N2 (78.08%), O2 (20.95%), CO2 (0.03%), H2O, H2 (5*10-5%), H2S, SO2, SO3, NO, N2O3, NO2, Cl2, NH3 и т.д.
Металл, попадающий в воздушную среду, сразу, атакуется окислителями, в частности кислородом. Например, железо, после прокатки в горячем состоянии сразу дает оксид:
2Fe+O2=2FeO, далее окисляясь,
4FeO+O2=2Fe2O3 дает рыхлый осадок полуторооксида, который реагирует со всеми кислыми оксидами и водой.
Т.е. во всех направлениях протекает реакции взаимодействия оксидов железа с кислотными оксидами, сероводородом и водой. В результате образуются соли и сложный оксид Fe3O4, который является известной всем ржавчиной. Эти вещества мелкокристаллические, легко сдуваемые с поверхности металла, и свежая поверхность готова к новому окислению и последующим реакциям.
а) Fe2O3+3CO2=Fe2(CO3)3 а1) FeO+CO2=FeCO3
в) Fe2O3+3H2S=Fe2S3+3H2O в1) FeO+SO2=FeSO3
с) Fe2O3+SO2=Fe2(SO3)3 с1) FeO+H2S=FeS+H2O
д) Fe2O3+3SO3=Fe2(SO4)3 д1) FeO+SO3=FeSO4
е) Fe2O3+N2O3=Fe(NO2)3 е1) FeO+N2O3=Fe(NO2)2
F e2O3+nH2O
Fe(OH)3
Fe3O4+H2O
e2O3+nH2O
Fe(OH)3
Fe3O4+H2O
Электрохимическая коррозия протекает в электролите. Металлические конструкции и приборы сделаны из сплавов, т.е. два или несколько металлов находятся в тесном контакте друг с другом. Попадая в электролит эти металлы (сплавы) создают огромное количество микрогальванических пар, которые окисляясь и восстанавливая водород из электролита, продуцируют электроток.

Н2О
 ооооо
ооооо


 Си
Си
 е е Fe
е е Fe
В воде всегда растворяется углекислый газ, поэтому на поверхности сплава имеется электролит:
Н2О+СО2=Н2СО3
Н 2СО3 Н++НСО3-.
Потенциалы Fe и Cu различны: ЕFeo= -0,44В, ЕCuо=+0,34В. Железо как более активный металл будет окисляться, а электроны потекут с Fe на Cu, где будут восстанавливаться катионы водорода из воды и кислоты.
F eo-2e=Fe+2 Fe+2+HCO3- =Fe(HCO3)2
2H++2e=H2o
Катионы железа образуют соль, которая будет растворяться в воде. Железо постепенно все окислится и конструкция разрушится.
Почва представляет собой насыщенный электролит, через который диффундируют газы. Элементарный состав почв (в %) по В. И. Вернадскому.
O 2
Si Al Fe Ca K Mg H2
Ti, C, Mn, Cl2,
S, P
2
Si Al Fe Ca K Mg H2
Ti, C, Mn, Cl2,
S, P
49.5 25.7 7.5 4.7 3.4 2.4 2.0 1.0 0.1-0.5
Т.е. элементы содержится в виде солей, оксидов. Соли подвергаются гидролизу грунтовыми водами, которые дают кислую или щелочную реакцию среды. Таким образом, металлические конструкции ( кабели, трубы) заложенные в землю очень быстро корродируют. В земле под городскими сооружениями, или вдоль линии электропередач всегда находится определенное напряжение от блуждающих токов, спускаемых в землю. Поэтому металлические конструкции прошиваются этими токами, приводя к разрушению металла, по типу анодного окисления.
e





В месте выхода тока из конструкции происходит окисление-разрушение металла. Часто почвенная коррозия сочетается с коррозией от блуждающих токов, что приводит к очень быстрому изнашиванию коммуникаций.
Металлы – кристаллические вещества, поэтому разрушение может протекать по-разному. Окисление слоями с поверхности – поверхностная коррозия. Растрескивание металла по ребрам кристаллической решетки – межкристаллитная. Питтинг-разрушение идет в глубину металла в виде ручейков:
- - -
- -
- - -
-
-




Методы защиты от коррозии
1. Изоляция металла от воздействия воздушной среды: покрытие маслами, лаками, пленками.
2. Металлические покрытия: анодное и катодное.
а
о оо оо
Zn Fe



Е Zno= -0.76B
EFeo= -0.44B
Цинк, покрывающий железо является анодом, если обнажаются оба слоя. Цинк, как более активный, будет разрушаться, а на железе будет происходить восстановление электролита, в частности катионов водорода.
Z n0-2e=Zn+2 Это покрытие безопасное, поскольку разрушается металл,
2H++2e=H20 предназначенный для защиты.
в
_ _
Sn Fe
Е Sn0= -0.13B
EFe0= -0.44B
Олово, имеющее более положительный потенциал, чем железо, достаточно хорошо защищает его. Но, если обнажатся оба слоя в случае аварии или другой причины, то именно железо, как более активный металл будет разрушаться, это опасное, катодное покрытие, поскольку разрушается основная конструкция.
F e0-2e=Fe+2 Sn0 остается в целости, пока не разрушится
2H++2e=H20 все железо.
3. Оксидирование металлов. Существуют металлы, которые образуют тонкую, эластичную, беспористую пленку с хорошей адгезией, т.е. плилипаемостью, как лаковая пленка. И эта пленка оксида нацело защищает металл от разрушения, поскольку она препятствует доступу кислорода к свежей поверхности металла. Такие металлы очень устойчивы к коррозии:
Zn – ZnO, Cr – Cr2O3, Al – Al2O3, Ti – TiO2 и т.д.
4. Протекторная защита. Применяется в тех случаях, когда защищаемая конструкция находится в среде электролита или морской, почвенной воде. Для этого в качестве протектора используют специальный анод-протектор, с более отрицательным потенциалом, т.е. более активный металл, который в первую очередь разрушается, защищая конструкцию. Например, паровой котел, находящийся под высокой температурой и давлением. В него впаивают лист цинка, служащим протектором. Рассчитывают скорость разрушения цинка и по мере расходования меняют на новый.
Zn




чугун
Z n0-2e=Zn+2 EZn0= -0.76B
2H++2e=H20 Eчуг0 -0,40В
Цинк-анод окисляется, на стенках чугуна-котла восстанавливается водород из воды.
Можно изменить коррозионную среду, вводя в электролит замедлители – ингибиторы коррозии. Эти вещества сдвигая потенциал в ту или иную сторону, уменьшают скорость коррозии. Например: альдегиды, нитриты, белки, гетероциклические соединения и т.д. Ингибиторы могут замедлять коррозию в сотни и тысячи раз.
Любые способы коррозии хороши, если они защищают металлы от разрушения. Коррозия наносит огромный ущерб стратегический, материальный, экономический, финансовый, приводя к человеческим жертвам (разрушение самолетов в воздухе в результате усталости металлов в силу длительной эксплуатации судна). Поэтому изучение и борьба с коррозией ведется во всех индустриально развитых странах.
Основная литература: [1] – стр. 251-259; [2] – стр. 230-251; [3] – стр. 143-148; [4] – стр. 184-188
Дополнительная литература: [6] – стр. 58-67; [12] – стр. 51-64, 93- 188 [13] – стр. 90-100, [23] – стр. 255-295, [24] – стр. 248-268, [25] – стр. 216-228, 276-279.
Контрольные вопросы:
Что называется степенью окисления?
Атомы каких элементов имеют постоянные степени окисления?
Какие реакции называются окислительно-восстановительными? Приведите примеры.
Какие вещества называются окислителями и какие – восстановителями? Назовите типичные окислители и восстановители.
Какие типы ОВР вы знаете?
В чем заключается метод электронного баланса?
В чем заключается ионно-электронный метод составления уравнений ОВР? Назовите его преимущества перед методом электронного баланса.
Тема лекции 8: Комплексные соединения. Теория комплексных соединений А. Вернера. Строение комплексных соединений: внутренняя и внешняя сферы. Комплексообразователь, лиганды, координационное число. Номенклатура комплексных соединений. Диссоциация КС. (1 час).
Комплексные соединения высшего порядка, образованные особым типом связи – донорно-акцепторным. Комплексные соединения самые древние соединения, которые использовал человек в своей практической деятельности! Это драгоценные камни, красители минерального или органического происхождения, это древние чернила-краски, используемые при написании на папирусах и т.д. Но изучил комплексные соединения и создал теорию, объясняющую их строение, только в 1893г. швейцарский химик А. Вернер.
Донорно-акцепторная связь образуется за счет готовой пары валентных электронов донора и пустой квантовой ячейки акцептора. Например в реакции
Cu(OH)2+4NH4OH=[Cu(NH3)4](OH)2+4H2O
↓ ↓
NH3 H2O
аммиак имеет готовую пару валентных электронов : NH3
7N 1S22S2p3
↑ ↓ |
↓ |
↓ |
↓ |
1Н 1S1
↑ |
↑ |
↑ |
2S2
Катион меди в гидроксиде Сu(OH)2 имеет пустые квантовые ячейки
атом 29Cu 1S22S2p63S2p64S13d10, т.е.
ион Сu+2 …4S0p0d0f0, пустые ячейки
|
|
|
|
|
|
|
|
|

 NH3
2+
NH3
2+
:
Сu2++4 : NH3= H3N:Cu:NH3
:
NH3
Нейтральный атом Сu имеет конец электронной формулы:…3d104S14p0 , а ион Сu2+ –
…3d94S04p0, т.е. 4-ый внешний энергетический уровень пустой. Катион меди координирует вокруг себя полярные молекулы аммиака, захватывая готовые пары валентных электронов аммиака в свои пустые ячейки. Возникающая связь донорно-акцепторная или координативная.
Комплексные соединения высшего порядка в отличие от соединений первого порядка – NaCl, H2O, … - имеют внутреннюю и внешнюю сферы. Внутренняя сфера заключается в квадратные скобки и содержит:
комплексообразователь,
лиганды или центральный атом,
координационное число – n.
Комплексообразователями выступают чаще всего ионы тяжелых металлов «d» и «f» семейств, реже «р» семейств, нейтральные атомы d-элементов Mn, Cr, Fe, Co, Ni.
Лигандами могут быть анионы кислотных остатков (ацидо-ионы): I-, Ba-, Cl-, F-, CN-, CNS-, NO2-, S2O32-, OH-…, а также полярные нейтральные молекулы:NH3, H2O, CO, NO…
Координационное число чаще всего в два раза больше степени окисления комплексообразователя, но бывают и исключения.
Комплексообразователь |
Координационное число |
Ag+, Cu+, Hg2+2, Au+1 |
2 |
Cu+2, Zn+2, Hg+2, Pt+2, Sn+2, Pb+2, Pd+2, Cd+2 |
4 |
Cr+3, Fe+2/Fe+3, Ni+2/Ni+3, Co+2/Co+3, Al+3, Au+3, Nb+4, Ta+4, Zr+4, Ge+4, Ti+4 |
6 |
Комплексные соединения образуются чаще всего в результате вторичных процессов, т.е. в результате растворения образующихся трудно растворимых соединений или образования гетерокислот:
1
 )
СuSO4+2NaOH=
Cu(OH)2
+Na2SO4
)
СuSO4+2NaOH=
Cu(OH)2
+Na2SO4
Cu(OH)2+4NH4OH=[Cu(NH3)4](OH)2+4H2O
↓ ↓
 NH3
H2O
NH3
H2O
ZnCl2+3/2KOH=2KCl+Zn(OH)2
Zn(OH)2+2KOH=K2[Zn(OH)4]
AuCl3+HCl=H[AuCl]
2KI+Hg(NO3)2=HgI2+2KNO3
HgI2+2KI=K2[HgI4]
Как видим, комплексные соединения могут быть гидроксидами, солями, кислотами, а комплексный ион может быть катионом или анионом - [Cr(NH3)6]+3, [PtCl6]-2. Заряд комплексного иона зависит от природы лиганда. Если лиганд нейтральная полярная молекула, образуется комплексный катион, если лиганд – кислотный остаток, образуется комплексный анион.
Заряд комплексного иона, т.е. внутренней сферы, подсчитывается как алгебраическая сумма зарядов всех ионов, входящих во внутреннюю сферу:
[Сr(NH3)6]+3 [HgI4]-2
↓ ↓ ↓ ↓
+3+0*6=+3 +2-1*4=-2
или подсчитывается как обратный заряд внешней сферы, если дана формула комплексного соединения
+3 -1 + -2
[Cr(NH3)6] (OH)3 K2[HgI4]
X+(-1*3)=0 +1*2+X=0
X=3 X=-2
Комплексные соединения бывают:
Однородные, если лиганды одного вида - [Pt(NH3)6]Cl4
Неоднородные, если лиганды разного вида – [Pt(NH3)4Cl2]Cl2
Комплексные неэлектролиты - [Pt(NH3)2Cl]0, [Ni(NO)4]0
Двойные комплексы – бикомплексы – т.е. и катион и анион – комплексные ионы –
[Ni(NH3)6]2[Fe(CN)6]
Aвто-комплексы - K[I*I2], Na[Br -*Br2]
Комплексные соединения сильные электролиты, диссоциирующие на внутреннюю и внешнюю сферы
K4[Fe(CN)6] = 4K++[Fe(CN)6]4-
Но комплексный ион слабый электролит, диссоциирующий незначительно.
Для характеристики силы комплексного иона выводится константа равновесия, называемая константой нестойкости, чем она меньше, тем прочнее комплексный ион.
[
 Co(NH3)6]2+
Co2++6NH30
[Co(NH3)6]+3
Co+3+6NH30
Co(NH3)6]2+
Co2++6NH30
[Co(NH3)6]+3
Co+3+6NH30
Как видно из константы нестойкости увеличение заряда центрального атома приводит к увеличению прочности комплексного иона.
Комплексные соединения могут вступать в различные химические реакции:
Реакции обмена
4FeCl3+3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ +12KCl
Реакции осаждения
Na3[Ag(S2O3)2]+KI = K2S2O3+Na2S2O3+AgI↓
Кн=1,0*10-13 ПР=1,5*10-16
Реакция окисления-восстановления
2K3[Fe(CN)6]+2KI = 2K4[Fe(CN)6]+I2
Реакции разложения комплексов
6500
K2[NbCl6] = NbCl4+2KCl и т.д.
По ЮИПАК название комплексного соединения составляется: в первую очередь называется катион, затем анион. Внутренняя сфера называется в следующем порядке:
комплексное число (2-ди, 4-тетра, 6-гекса);
лиганд + «о» (хлор-о, циан-о);
центральный атом в латинской транскрипции в родительном или винительном падеже.
В неоднородных комплексах порядок названия следующий:
комплексное число;
ацидо-лиганд, нейтральный лиганд;
центральный атом.
Например:
а) K3[Fe(CN)6] – гексацианоферрат(III) калия, в) [Co(NH3)4Cl2]SO4 – сульфат дихлоротетрааммино кобальта(III).
Существуют двойные соли сложные по составу, состоящие из двух катионов, соединенных с одним анионом. Принципиальное отличие двойных солей от комплексных соединений – их полная диссоциация на все компоненты. Например:
(NH4)2*Fe*(SO4)2*24H2O – соль Мора Fe(II) и Fe(III),
NH4*Fe*(SO4)2*24H2O – железо-аммонийные квасцы,
K*Al*(SO4)2*nH2O – алюмокалийные квасцы.
Доказательством отличия двойных солей от комплексных соединений являются качественные реакции на каждый ион.
NH4*Fe*(SO4)2+4KOH=NH4OH+Fe(OH)3↓+2K2SO4
2NH4*Fe*(SO4)2+6KCNS=(NH4)2+2Fe(CNS)3+3K2SO4
рубиновый
NH4*Fe*(SO4)2+2BaCl2=NH4Cl+FeCl3+2BaSO4
K3[Fe(CN)6]+NaCNS= окраска не появляется.
Комплексные соединения самые распространенные соединения в неорганической химии. Кислотные остатки высших кислот(SO4-2, PO4-3, NO3-, CO3-2, MnO4-, CrO4-2 и т.д.) являются настолько прочными комплексами, что квадратные скобки даже не пишут, константа нестойкости их ничтожно малые величины, порядка 10-70 степени. Они называются оксолями и разрушаются только в ОВР.
С учетом сказанного комплексные соединения имеют широчайшее применение во всех сферах деятельности человека.
Основная литература: [1] – стр. 71-82, [2] – стр. 138-162; [3] – стр. 224-234; [4] – стр. 360-364.
Дополнительная литература: [6] – стр. 186-188, [23] – стр. 563-587, [24] – стр. 175-197, [25] – стр. 124-140.
Контрольные вопросы:
Какие соединения называются комплексными?
Что такое комплексообразователь? Приведите примеры.
Какие частицы могут быть лигандами?
Приведите примеры комплексных катионов, анионов, нейтральных комплексов.
Что характеризует константа нестойкости?
Чем определяется дентатность лиганда?
Как метод валентных связей определяет связь в комплексах? Что является донором, акцептором?
Как теория поля лигандов объясняет связь в комплексах?
В какие химические реакции могут вступать комплексные соединения?
Назовите области применения комплексных соединений.
2.3 Планы лабораторных занятий
1. Лабораторная работа №1. Классы неорганических соединений.
Задание:
1. Получить гидроксиды из основного и кислотного оксида.
2. Получить нерастворимые гидроксиды и исследовать их прочность.
3. Получить нормальные, кислые и основные соли.
4. Получить амфотерные гидроксиды и изучить их свойства.
Цель работы.
Изучение химических свойств и способов получения классов неорганических соединений (оксидов, гидроксидов, кислот, солей), изучение амфотерности гидроксидов и различных типов солей. Теоретический материал представлен в модуле 1
Техника безопасности.
При выполнении работы пользоваться химическими реактивами аккуратно, не допуская разбрызгивания и проливания реактивов на лабораторный стол и одежду.
Теоретические основы и ход работы.
Оксидами называются сложные соединения, состоящие из двух элементов, одним из которых является кислород. Основные оксиды: металл – кислород K2O, CaO, BaO, CuO, Fe2O3 и т.д. Кислотные оксиды: неметалл - кислород CO2, N2O5, SO2, P2O5 и т.д.
Гидроксидами (основаниями) называются сложные соединения, состоящие из катионов металлов, соединенных с гидрокидными группами NaOH, KOH, Ca(OH)2, Ba(OH)2, Fe(OH)3 и т.д.
Кислотами называются сложные соединения, состоящие из катионов водорода, способных замещаться на металл, и кислотного остатка. HCl, H2SO4, HNO3, H2CO3, H3PO4 и т.д.
Солями называются сложные соединения, состоящие из катионов металлов, соединенных с кислотными остатками. Средние (нормальные) соли: NaCl, FeCl3, K2CO3 и т.д. Основные соли: MgOHCl2, Al(OH)2Cl, AlOHCl2 и т.д. Химическими реакции, протекающие в ниже приведенных опытах, оформить в виде химических уравнений в молекулярной и ионной формах.
Необходимые реактивы: а) штатив с пробирками, аппарат Кипа; б) оксиды - CaO, BaO, CO2 (из аппарата Киппа); в) растворы солей: никеля, железа (ΙΙΙ), меди, алюминия, хрома, цинка; г) растворы гидроксидов: натрия, калия, кальция; д) раствор азотной или соляной кислоты.
Опыт 1. Взаимодействие оксидов металлов и неметаллов с водой.
а) В две пробирки налить 2-3мл дистиллированной воды и растворить оксиды CaO и BaO (на кончике шпателя).
б) В пробирку налить 2-3мл дистиллированной воды и пропустить через воду диоксид углерод (ΙV) (из аппарата Киппа).
Опыт 2. Получение нерастворимых гидроксидов меди, никеля и железа.
Взять три пробирки. Налить в пробирки 2-3мл растворов солей: в 1-ю соли меди, во 2-ю соли никеля, в 3-ю соли железа(ΙΙΙ). В каждую пробирку прилить 2-3мл раствора гидроксида натрия или гидроксида калия до выпадения осадков. Отметить цвет выпавших осадков. Осадки сохранить!
Опыт 3. Прочность гидроксидов.
Осадки гидроксидов меди, никеля, железа(ΙΙΙ), полученные в опыте2, осторожно нагреть вместе с жидкостью почти до кипения. Отметить, какой гидроксид меняет цвет, все ли гидроксиды при нагревании разлагаются. Осадки сохранить!
Опыт 4. Нормальные соли меди, никеля, железа(ΙΙΙ).
К осадкам, полученным в опыте 3, прилейте раствор азотной кислоты HNO3 до полного растворения осадков.
Опыт 5. Кислые соли кальция.
а) Налейте 1/3 пробирки гидроксида кальция и пропускайте в него диоксид углерода из аппарата Киппа до появления осадка, затем до растворения выпавшего осадка карбоната кальция.
б) Раствор бикарбоната кальция, полученный в опыте 5а, разделите на 3 пробирки поровну. Содержимое 1-ой пробирки нагрейте до кипения, отметьте постепенное появление мути. К содержимому 2-ой пробирки прибавьте раствор гидроксида кальция, к 3-ей пробирке добавьте раствор карбоната натрия. Отметьте постепенное выпадение осадка во всех трех пробирках.
Опыт 6. Основные соли меди и кобальта.
а) В две пробирки налить 2-3мл раствора сульфата меди. В 1-ую пробирку прибавьте равный объем гидроксида натрия до появления синего осадка. Во 2-ую пробирку раствор гидроксида натрия приливайте по каплям до появления голубого осадка. Осторожно нагрейте оба осадка для кипения. Объясните почему в 1-ой пробирке осадок почернел, а во 2-ой – нет.
б) К раствору хлорида кобальта по каплям при перемешивании прибавьте раствор гидроксида натрия до образования осадка. Какого цвета осадок? Разделите полученный осадок вместе с жидкостью на 2 пробирки. В одну прилейте равный объем гидроксида натрия и нагрейте. В другую – раствор соляной кислоты до полного растворения осадка.
Опыт 7. Амфотерные гидроксиды.
а) К 2-3мл раствора соли алюминия по каплям при перемешивании прибавьте гидроксид калия КОН до появления осадка. Разделите полученный осадок вместе с жидкостью на 2 пробирки. К одной порции добавьте избыток гидроксида калия, к другой – кислоты до полного растворения в той и другой пробирке. Напишите уравнения реакций получения гидроксида алюминия тетрагидроксоалюмината калия КAl(OH)4 и нормальной соли.
б) Такие же опыты проведите взяв соли цинка и хрома.
1.6. Самостоятельная работа: напишите 10 способов получения нармальных солей.
1.7. Оформление работы
В лабораторную тетрадь записывать только заголовки опытов, уравнения реакций в молекулярной и ионной формах, характерные особенности полученных веществ (осадок, цвет и т.д.)
Основная литература: [1], стр. 12,16.
Контрольные вопросы:
1. Как получить оксиды CuO, CO2, SO2, P2O5, MgO из простых и сложных веществ?
2. Основные свойства какого гидроксида выражены сильнее: As(OH)3 или Bi(OH)3; Ba(OH)2 или Be(OH)2. Чем это объясняется?
3. Перечислите и напишите формулы: труднорастворимых сульфатов и хлоридов; хорошо растворимых карбонатов и фосфатов.
4. С какими из перечисленных веществ взаимодействует соляная кислота: CaO, SO3, CuSO4, Cu, Zn?

 1.Основные
оксиды взаимодействуют с кислотами,
получаются соль и вода:
1.Основные
оксиды взаимодействуют с кислотами,
получаются соль и вода:








 HCl
HCl H2S
H2S