
- •1. Предмет и задачи биофизики
- •2. Термодинамика
- •3.Биоэнергетика.
- •Электронная схема жизни
- •Трансмембранный электрохимический потенциал – унифицированная форма энергии в клетке
- •Принцип энергетического сопряжения.
- •Законы биоэнергетики.
- •Третий закон биоэнергетики
- •Общая схема энергетических преобразований в клетке Молекулярные механизмы процессов энергетического сопряжения - хемиосмотическая теория Митчела
- •Химические свойства
- •[Править]Роль в организме
- •Пути синтеза
- •Энергетика фотосинтеза
- •Уникальность фотосинтеза как физико-химического процесса.
- •4. Кинетика биологических процессов Кинетическая классификация химических реакций. Типы реакций.
- •Кинетические признаки, лежащие в основе различий простой и сложной реакций
- •Типы простых мономолекулярных и бимолекулярных реакций
- •Особенности кинетики биологических процессов
- •Скорость реакции
- •Зависимость скорости реакции от температуры.
- •Уравнение Аррениуса
- •График Аррениуса для биологических процессов
- •2. Обменно-резонансный.
- •3. Экситонный механизм.
- •Индуктивно-резонансный перенос
- •Что такое свободные радикалы?
- •Классификация свободных радикалов, образующихся в нашем организме
- •Биологические последствия пероксидации липидов
- •9. Биофизика фотобиологических процессов Фотобиологические процессы. Классификация фотобиологических процессов.
- •Участие пигментов в преобразовании энергии квантов
- •Зрение: строение зрительной клетки. Родопсин, фотопревращение родопсина
- •Фотодеструктивные процессы. Их общая характеристика.
- •10. Молекулярная биофизика.
- •Уровни структурной организации белков:
- •Роль слабых взаимодействий ближнего и дальнего порядка в самоорганизации белковой молекулы
- •Структурные и энергетические факторы, определяющие динамическую подвижность белков, потенциал Леннард-Джонса.
- •Конформационные изменения в белке
- •Ферме́нты
- •Ферментативный катализ
- •Электронно-конформационные взаимодействия
- •11. Биофизика механохимических процессов.
- •12.Биофизика мембранных процессов.
- •Мембрана как универсальный компонент биологических систем.
- •Плазматическая мембрана, химический состав биологических мембран
- •Классификация, принципы построения и характеристика мембранных липидов
- •Модельные липидные системы: монослои, мицеллы, липосомы.
- •Фазовые переходы липидов, температура фазового перехода
- •Молекулярная подвижность липидов: сегментарная, вращательная, латеральная, флип-флоп переходы
- •13. Функции биомембран Барьерная функция биомембран
- •Транспорт веществ через биомембраны
- •Движущие силы мембранного транспорта
- •Классификация транспорта веществ через мембраны
- •Механизмы пассивного мембранного транспорта
- •Уравнение Фика
- •Электродиффузионное уравнение Нэрнста-Планка
- •Ионный транспорт через каналы
- •Ионофоры
- •Облегчённая диффузия
- •Транспорт глюкозы в эритроцит
- •Активный транспорт
- •14. Электрические явления в мембранах Ионные токи через возбудимую мембрану
- •Стационарный потенциал Гольдмана-Ходжкина-Катца
- •Изменение мембранного потенциала при возбуждении, потенциал действия.
- •Распространение потенциала действия по нервному волокну
- •Роль локальных токов в распространении пд
- •15. Молекулярные механизмы рецепторных процессов Общая ха-ка процессов передачи информации в клетке: первичные мессенджеры, взаимодействия эффектор-рецептор, пути трансдукции рецепторного сигнала
- •Виды внутриклеточной сигнализации: аденилатциклазный и фосфоинозитидный пути трансдукции рецепторного сигнала
- •Вторичные мессенджеры
Виды внутриклеточной сигнализации: аденилатциклазный и фосфоинозитидный пути трансдукции рецепторного сигнала
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков:
1) рецептор гормона;
2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ);
3) G-белок, осуществляющий связь между аденилатциклазой и рецептором;
4) цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность;
5) фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала.
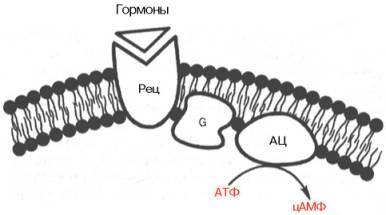
Получены в чистом виде α- и β-адренергические рецепторы из плазматических мембран клеток печени, мышц и жировой ткани. Показано, что связывание гормона с β-адренергическим рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что в свою очередь обеспечивает взаимодействие рецептора со вторым белком сигнального пути – ГТФ-связывающим.
ГТФ-связывающий белок – G-белок – представляет собой смесь 2 типов белков: активного Gs и ингибиторного Gi. В составе каждого из них имеется три разные субъединицы (α-, β- и γ-). Показано, что β-субъединицы Gs и Gi идентичны; в то же время α-субъединицы, оказались ответственными за проявление G-белком активаторной и ингибиторной активности соответственно. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg2+ на β-, γ-субъединицы и комплекс α-субъединицы Gs в ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации β- и γ-субъединиц с образованием первоначальной ГДФ-формы Gs.
В этом механизме передачи сигнала в клетку активное участие принимают мембранные фосфолипиды, в частности, фосфатидилинозитол.

а, β, у - субъединицы G-белка. Связывание агониста с рецептором (1) приводит к активации рецептора и последующей активации гетеротримерного G-белка (2). G-белок диссоциирует на a-ГТФ и Ру-димер. а-ГТФ активирует фосфолипазу С, которая катализирует гидролиз фосфатидилинозитол-4,5-дифосфата (Р1Р2) с образованием диацилглицерина (DAG) и инозитол-1,4,5-трифосфата (1Р3) (3). IP- вызывает мобилизацию Са2+ из депо (4). Повышение [Ca2+]j приводит к активации Са2+-кальмодулин-зависимой протеинкиназы (Са"+/СаМ киназы), которая фосфорилирует белки-мишени (7) и вызывает клеточный ответ (8). DAG и увеличение [Ca2+]j вызывают активацию протеинкиназы С (5), которая фосфорилирует белки-мишени по остаткам серина и треонина (6).
Вторичные мессенджеры
Вторичные посредники (вторичные мессенджеры) — это малые сигнальные молекулы, компоненты системы передачи сигнала в клетке. Вторичные посредники являются компонентами каскадов передачи сигнала, быстро образуются и далее активируют эффекторные белки, которые опосредуют ответ клетки. К наиболее распространенным вторичным посредникам относятся цАМФ (сAMP), цГТФ (cGTP), Са2+, инозит-1,4,5-трифосфат [ИФ3 (lnsP3)], диацилглицерин [ДАГ (DAG)] и монооксид азота (NO).
цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α). В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина.
Наряду с цАМФ функции вторичного мессенджера может выполнять и цГМФ (cGMP). Оба соединения различаются по метаболизму и механизму действия.
Действие кальция опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин.
Гидрофильный ИФ3 поступает в эндоплазматический ретикулум и индуцирует высвобождение ионов Са2+ из запасающих везикул. Липофильный ДАГ остается в мембране и активирует протеинкиназу C, которая в присутствии Са2+ фосфорилирует различные белковые субстраты, модулируя их функциональную активность.
