
- •1. Предмет и задачи биофизики
- •2. Термодинамика
- •3.Биоэнергетика.
- •Электронная схема жизни
- •Трансмембранный электрохимический потенциал – унифицированная форма энергии в клетке
- •Принцип энергетического сопряжения.
- •Законы биоэнергетики.
- •Третий закон биоэнергетики
- •Общая схема энергетических преобразований в клетке Молекулярные механизмы процессов энергетического сопряжения - хемиосмотическая теория Митчела
- •Химические свойства
- •[Править]Роль в организме
- •Пути синтеза
- •Энергетика фотосинтеза
- •Уникальность фотосинтеза как физико-химического процесса.
- •4. Кинетика биологических процессов Кинетическая классификация химических реакций. Типы реакций.
- •Кинетические признаки, лежащие в основе различий простой и сложной реакций
- •Типы простых мономолекулярных и бимолекулярных реакций
- •Особенности кинетики биологических процессов
- •Скорость реакции
- •Зависимость скорости реакции от температуры.
- •Уравнение Аррениуса
- •График Аррениуса для биологических процессов
- •2. Обменно-резонансный.
- •3. Экситонный механизм.
- •Индуктивно-резонансный перенос
- •Что такое свободные радикалы?
- •Классификация свободных радикалов, образующихся в нашем организме
- •Биологические последствия пероксидации липидов
- •9. Биофизика фотобиологических процессов Фотобиологические процессы. Классификация фотобиологических процессов.
- •Участие пигментов в преобразовании энергии квантов
- •Зрение: строение зрительной клетки. Родопсин, фотопревращение родопсина
- •Фотодеструктивные процессы. Их общая характеристика.
- •10. Молекулярная биофизика.
- •Уровни структурной организации белков:
- •Роль слабых взаимодействий ближнего и дальнего порядка в самоорганизации белковой молекулы
- •Структурные и энергетические факторы, определяющие динамическую подвижность белков, потенциал Леннард-Джонса.
- •Конформационные изменения в белке
- •Ферме́нты
- •Ферментативный катализ
- •Электронно-конформационные взаимодействия
- •11. Биофизика механохимических процессов.
- •12.Биофизика мембранных процессов.
- •Мембрана как универсальный компонент биологических систем.
- •Плазматическая мембрана, химический состав биологических мембран
- •Классификация, принципы построения и характеристика мембранных липидов
- •Модельные липидные системы: монослои, мицеллы, липосомы.
- •Фазовые переходы липидов, температура фазового перехода
- •Молекулярная подвижность липидов: сегментарная, вращательная, латеральная, флип-флоп переходы
- •13. Функции биомембран Барьерная функция биомембран
- •Транспорт веществ через биомембраны
- •Движущие силы мембранного транспорта
- •Классификация транспорта веществ через мембраны
- •Механизмы пассивного мембранного транспорта
- •Уравнение Фика
- •Электродиффузионное уравнение Нэрнста-Планка
- •Ионный транспорт через каналы
- •Ионофоры
- •Облегчённая диффузия
- •Транспорт глюкозы в эритроцит
- •Активный транспорт
- •14. Электрические явления в мембранах Ионные токи через возбудимую мембрану
- •Стационарный потенциал Гольдмана-Ходжкина-Катца
- •Изменение мембранного потенциала при возбуждении, потенциал действия.
- •Распространение потенциала действия по нервному волокну
- •Роль локальных токов в распространении пд
- •15. Молекулярные механизмы рецепторных процессов Общая ха-ка процессов передачи информации в клетке: первичные мессенджеры, взаимодействия эффектор-рецептор, пути трансдукции рецепторного сигнала
- •Виды внутриклеточной сигнализации: аденилатциклазный и фосфоинозитидный пути трансдукции рецепторного сигнала
- •Вторичные мессенджеры
Уровни структурной организации белков:
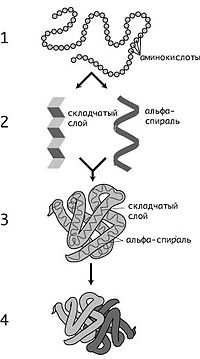
1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков. Важными особенностями первичной структуры являются консервативные мотивы — устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков: α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[22] (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена.
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали
π-спирали;
неупорядоченные фрагменты.
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Стабильность третичной структуры зависит от системы нековалентных взаимодействий внутри белковой глобулы. Некоторые белки дополнительно стабилизируются ковалентными - дисульфидными связями; однако немало белков, в том числе достаточно стабильных, вовсе их лишены. Среди нековалентных взаимодействий, реализующихся при образовании пространственной структуры белка, наибольшую точность в фиксировании межатомных расстояний и углов обеспечивают водородные связи.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Виды объемных взаимодействий в молекуле белка: водородные связи, физическая природа водородных связей; силы Ван-дер-Ваальса; электростатические взаимодействия; гидрофобные взаимодействия в биоструктурах
В нуклеиновых кислотах и белках водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах, водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК, определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
Ван-дер-ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль, применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году. Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкость и твёрдые тела). К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными).
Классификация ван-дер-ваальсовых сил Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Электростатические взаимодействия
реализуются в белках как между разно-, так и одноименно заряженными группами. Наиболее важны так называемые солевые мостики, которые возникают между положительно и отрицательно заряженными группами белка.
Данные взаимодействия подчиняются закону Кулона. Свободная энергия образования солевых мостиков зависит от среды, в которой они локализованы. Во внутренней неполярной области белка данная величина составляет порядка –5 ккал/моль (сравните со значением для ковалентной пептидной связи), а в приповерхностных слоях белка – в 10-20 раз меньше.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NН3+ и СОО- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
