
- •1. Предмет и задачи биофизики
- •2. Термодинамика
- •3.Биоэнергетика.
- •Электронная схема жизни
- •Трансмембранный электрохимический потенциал – унифицированная форма энергии в клетке
- •Принцип энергетического сопряжения.
- •Законы биоэнергетики.
- •Третий закон биоэнергетики
- •Общая схема энергетических преобразований в клетке Молекулярные механизмы процессов энергетического сопряжения - хемиосмотическая теория Митчела
- •Химические свойства
- •[Править]Роль в организме
- •Пути синтеза
- •Энергетика фотосинтеза
- •Уникальность фотосинтеза как физико-химического процесса.
- •4. Кинетика биологических процессов Кинетическая классификация химических реакций. Типы реакций.
- •Кинетические признаки, лежащие в основе различий простой и сложной реакций
- •Типы простых мономолекулярных и бимолекулярных реакций
- •Особенности кинетики биологических процессов
- •Скорость реакции
- •Зависимость скорости реакции от температуры.
- •Уравнение Аррениуса
- •График Аррениуса для биологических процессов
- •2. Обменно-резонансный.
- •3. Экситонный механизм.
- •Индуктивно-резонансный перенос
- •Что такое свободные радикалы?
- •Классификация свободных радикалов, образующихся в нашем организме
- •Биологические последствия пероксидации липидов
- •9. Биофизика фотобиологических процессов Фотобиологические процессы. Классификация фотобиологических процессов.
- •Участие пигментов в преобразовании энергии квантов
- •Зрение: строение зрительной клетки. Родопсин, фотопревращение родопсина
- •Фотодеструктивные процессы. Их общая характеристика.
- •10. Молекулярная биофизика.
- •Уровни структурной организации белков:
- •Роль слабых взаимодействий ближнего и дальнего порядка в самоорганизации белковой молекулы
- •Структурные и энергетические факторы, определяющие динамическую подвижность белков, потенциал Леннард-Джонса.
- •Конформационные изменения в белке
- •Ферме́нты
- •Ферментативный катализ
- •Электронно-конформационные взаимодействия
- •11. Биофизика механохимических процессов.
- •12.Биофизика мембранных процессов.
- •Мембрана как универсальный компонент биологических систем.
- •Плазматическая мембрана, химический состав биологических мембран
- •Классификация, принципы построения и характеристика мембранных липидов
- •Модельные липидные системы: монослои, мицеллы, липосомы.
- •Фазовые переходы липидов, температура фазового перехода
- •Молекулярная подвижность липидов: сегментарная, вращательная, латеральная, флип-флоп переходы
- •13. Функции биомембран Барьерная функция биомембран
- •Транспорт веществ через биомембраны
- •Движущие силы мембранного транспорта
- •Классификация транспорта веществ через мембраны
- •Механизмы пассивного мембранного транспорта
- •Уравнение Фика
- •Электродиффузионное уравнение Нэрнста-Планка
- •Ионный транспорт через каналы
- •Ионофоры
- •Облегчённая диффузия
- •Транспорт глюкозы в эритроцит
- •Активный транспорт
- •14. Электрические явления в мембранах Ионные токи через возбудимую мембрану
- •Стационарный потенциал Гольдмана-Ходжкина-Катца
- •Изменение мембранного потенциала при возбуждении, потенциал действия.
- •Распространение потенциала действия по нервному волокну
- •Роль локальных токов в распространении пд
- •15. Молекулярные механизмы рецепторных процессов Общая ха-ка процессов передачи информации в клетке: первичные мессенджеры, взаимодействия эффектор-рецептор, пути трансдукции рецепторного сигнала
- •Виды внутриклеточной сигнализации: аденилатциклазный и фосфоинозитидный пути трансдукции рецепторного сигнала
- •Вторичные мессенджеры
Что такое свободные радикалы?
Хорошо известно, что в органических молекулах (включая те, из которых состоит наш организм) электроны на внешней электронной оболочке располагаются парами: одна пара на каждой орбитали. Свободные радикалы отличаются от обычных молекул тем, что у них на внешней электронной оболочке имеется неспаренный (одиночный) электрон. Это делает радикалы химически активными, поскольку радикал стремится вернуть себе недостающий электрон, отняв его от окружающих молекул и тем самым их повреждая. Неспаренный электрон в радикалах принято обозначать точкой. Например, радикал гидроксила обозначают как HO·, радикал перекиси водорода как HOO·, радикал супероксида как ·OO- или O2·-. Ниже даны формулы двух радикалов этилового спирта:
CH3CH2O·; CH3•СHOH |
Классификация свободных радикалов, образующихся в нашем организме
Согласно предложенной нами классификации, все радикалы, образующиеся в нашем организме, можно разделить на природные и чужеродные. В свою очередь природные радикалы можно разделить на первичные (полезные), вторичные (повреждающие) и третичные (радикалы антиоксидантов) (см. схему на рис.2 и таблицы 1 и 2). Образование первичных радикалов осуществляется при участии определенных ферментных систем; эти радикалы выполняют полезные для организма функции. Из первичного радикала – супероксида, а также в результате других реакций в организме могут образоваться весьма активные молекулярные соединения: перекись водорода, гипохлорит и гидроперекиси липидов. Под действием ионов металлов переменной валентности, в первую очередь – ионов Fe2+, из этих веществ образуются вторичные свободные радикалы, такие как радикал гидроксила и радикалы липидов, которые оказывают разрушительное действие на клеточные структуры (таблица 2).
Таблица 1. Первичные радикалы, образующиеся в нашем организме
Название радикала |
Структура радикала |
Ферментная система, ответственная за образование радикала |
Биологическая роль радикала |
Супероксид |
·OO- |
НАДФН-оксидаза |
Антимикробная защита |
Нитроксид |
·NO |
NO-синтаза |
Фактор расслабления сосудов |
Убихинол |
·Q |
Дыхательная цепь митохондрий |
Переносчик электронов |
Таблица 2. Вторичные радикалы
Название радикала |
Структура радикала |
Образуется в реакции |
Радикал гидроксила |
·OH |
Fe2+ + HOOH -> Fe3+ + HO- + ·OH Fe2+ + ClO- + H+ -> Fe3+ +Cl - + ·OH |
Липидные радикалы |
LO· L· LOO· |
Fe2+ + LOOH -> Fe3+ + HO- + LO· LO· + LH -> LOH + L· L· + O2 -> LOO· |
Перечисленные в таблицах 1 и 2 радикалы можно считать природными, поскольку они в определенном количестве всегда образуются в наших клетках. Наряду с этими радикалами разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например, светом лазера. Такие радикалы можно назвать чужеродными. К ним принадлежат также радикалы, образующиеся из попавших в организм посторонних соединений, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений.
Вторичные и третичные радикалы
Реактивные молекулы: перекись водорода, гидроперекиси липидов, пероксинитрит, - образуются в реакциях, одним из участников которых в большинстве случаев является радикал, а иногда - диоксиген, который, впрочем, тоже имеет неспаренные электроны на внешней электронной оболочке. В свою очередь, эти молекулы, а наряду с ними - гипохлорит, охотно образуют радикалы в присутствии ионов металлов переменной валентности, в первую очередь - ионов двухвалентного железа. Такие радикалы мы будем называть вторичными; сюда относятся радикал гидроксила и радикалы липидов. Вторичные радикалы, в отличие от первичных, образуются в неферментативных реакциях и, насколько известно в настоящее время, не выполняют физиологически-полезных функций. Напротив, они обладают разрушительным действием на клеточные структуры и с полным основанием могут быть названы вредными радикалами. Именно образование вторичных радикалов (а не радикалов вообще) приводит к развитию патологических состояний и лежит в основе канцерогенеза, атеросклероза, хронических воспалений и нервных дегенеративных болезней (см. обзоры {Cross, 1987 #4}{Cross, 1994 #5}{Darley-Usmar, 1995 #10}{Darley-Usmar, 1996 #11}). Впрочем, реактивные молекулы также обладают цитотоксическим действием, причем не только благодаря образованию из них свободных радикалов, но и непосредственно, как это доказано для пероксинитрита и гипохлорита, а в некоторых ситуациях - и для перекиси водорода.
Для защиты от повреждающего действия вторичных радикалов в организме используется большая группа веществ, называемых антиоксидантами, к числу которых принадлежат ловушки, или перехватчики свободных радикалов. Примером последних служат альфа-токоферол, тироксин, восстановленный убихинон (QH2) и женские стероидные гормоны. Реагируя с липидными радикалами, эти вещества сами превращаются в радикалы антиоксидантов, которые можно рассматривать как третичные радикалы (см. рис. 3).
Наряду с этими радикалами, постоянно образующимися в том или ином количестве в клетках и тканях нашего организма, разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например, светом лазера. Такие радикалы можно назвать чужеродными. К ним принадлежат также радикалы, образующиеся из попавших в организм посторонних соединений, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений (рис. 3).
Все радикалы, образующиеся в человеческом организме, можно разделить на природные и чужеродные. В свою очередь природные радикалы можно разделить на первичные, вторичные и третичные (См. схему на рис. 4).
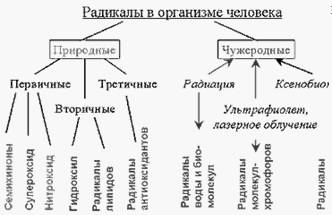
Рисунок 1.4. Классификация свободных радикалов, образующихся в нашем организме
Первичными можно назвать радикалы, образование которых осуществляется при участии определенных ферментных систем. Прежде всего к ним относятся радикалы (семихиноны), образующиеся в реакциях таких переносчиков электронов, как коэнзим Q (обозначим радикал как Q·) и флавопротеины. Два других радикала - супероксид (·OO-) и монооксид азота (·NO) также выполняют полезные для организма функции, которые будут подробнее рассмотрены в соответствующих разделах.
Из первичного радикала - супероксида, а также в результате других реакций, в организме образуются весьма активные молекулярные соединения: перекись водорода, гипохлорит и гидроперекиси липидов (см. рис. 5). Такие молекулы, наряду с радикалами, получили в англоязычной литературе название "reactive species", что в русской литературе чаще всего переводится как "активные формы". Чтобы провести водораздел между радикалами и молекулярными продуктами, мы предлагаем называть последние "реактивными молекулами". Таким образом, предлагается такая терминология:
Активные формы = свободные радикалы + реактивные молекулы
Halliwell предлагает термины активные формы кислорода, азота и хлора {Halliwell, 1998 #9}. Как видно из схемы на рис. 5, к активным формам кислорода относятся супероксид, радикал гидроксила, перекись водорода и синглетный кислород. Окись азота и результат ее взаимодействия с супероксидом - пероксинитрит предлагается называть активными формами азота. Активной формой хлора можно назвать гипохлорит, образуемый в реакции перекиси водорода с ионом хлорида, которую катализирует фермент миелопероксидаза.
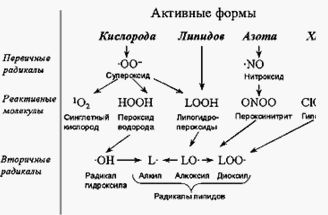
Рисунок 1.5. Активные формы (Reactive species) кислорода, азота и хлора
В складывающейся в настоящее время терминологии нужно найти место радикалам и гидроперекисям полиненасыщенных жирных кислот, которые образуются в очень важной реакции цепного окисления липидов. С химической точки зрения - это неоднородная группа. При отрыве атома водорода от молекулы полиненасыщенной жирной кислоты образуется алкоксильный радикал, в котором неспаренный электрон локализован у углеродного атома. Это как бы "активная форма углерода". Но при дальнейшем взаимодействии алкильного радикала с диоксигеном (молекулярным кислородом) образуется диоксид-радикал с локализацией неспаренного электрона на атоме кислорода. По структуре, и отчасти по свойствам, такой радикал напоминает супероксид, и его можно отнести к активным формам кислорода, что и делают некоторые авторы. Образующиеся при перекисном окислении липидов гидроперекиси ненасыщенных жирных кислот также можно отнести к этой категории активных форм, по аналогии с пероксидом водорода. В эту же категорию попадают тогда и алкоксильные радикалы липидов, образующиеся при одноэлектронном восстановлении гидроперекисей, например, ионами Fe2+; по сути, это гомологи гидроксильного радикала.
Несмотря на все сказанное, мы предлагаем объединить все перечисленные продукты (и реагенты) цепного окисления липидов одним термином: активные формы липидов. Для биолога и врача все же важнее, не у какого именно атома локализован непарный электрон, а какая молекула при этом становится химически агрессивной, т. е. приобретает черты свободного радикала или его реактивного предшественника. Итак, к активным формам липидов мы отнесем алкильные, алкоксильные и диоксид-радикалы. а также гидроперекиси полиненасыщенных жирных кислот и соответствующих цепей фосфолипидов, триглицеридов или холестерина (см.рис. 5).
СВОБОДНОРАДИКАЛЬНОЕ (ПЕРЕКИСНОЕ) ОКИСЛЕНИЕ ЛИПИДОВ
Реакция цепного окисления липидов играет исключительную роль в клеточной патологии, и следует остановиться на ее механизме [3]. Реакция протекает в несколько стадий, которые получили название "инициирование", "продолжение", "разветвление" и "обрыв" цепи (рис. 3).
Рассмотрим эти стадии подробнее. Инициирование цепной реакции начинается с того, что в липидный слой мембран или липопротеинов внедряется свободный радикал. Чаще всего это радикал гидроксила. Будучи небольшой по размеру незаряженной частицей, он способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом образуются липидные радикалы:
HOJ + LH H2O + LJ
Липидный радикал (LJ) вступает в реакцию с растворенным в среде молекулярным кислородом, при этом образуется новый свободный радикал - радикал липоперекиси (LOOJ):
LJ + O2 LOOJ
Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала LJ:
LOOJ + LH LOOH + LJ
Чередование двух последних реакций и представляет собой цепную реакцию пероксидации (перекисного окисления) липидов (см. рис. 3, вверху). Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2 + c гидроперекисями липидов:
Fe2 + + LOOH Fe3 + + HO- + LOJ
Образующиеся радикалы LOJ инициируют новые цепи окисления липидов (см. рис. 3, внизу):
LOJ + LH LOH + LJ; LJ + O2 LOOJ и т.д.
В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2 +) или друг с другом:
LOOJ + Fe2 + + H+ LOOH,
LOOJ + InH InJ,
LOOJ + LOOJ молекулярные продукты.
Последняя реакция особенно интересна, поскольку она сопровождается свечением (хемилюминесценцией). Интенсивность сверхслабого свечения однозначно отражает скорость липидной пероксидации в изучаемом биологическом материале, и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах [2-4].
Биологические последствия пероксидации липидов. Увеличенное образование свободных радикалов в организме (которое иногда называют оксидативным стрессом) и связанное с этим усиление процессов пероксидации липидов сопровождаются нарушениями в свойствах биологических мембран и функционировании клеток. Наиболее изучены три прямых следствия перекисного окисления липидов. Первое следствие - перекисное окисление липидов сопровождается окислением тиоловых (сульфгидрильных) групп мембранных белков (Pr). Это может приводить в результате к неферментативной реакции SH-групп со свободными радикалами липидов. При этом образуются сульфгидрильные радикалы, которые затем взаимодействуют с образованием дисульфидов либо окисляются кислородом с образованием производных сульфоновой кислоты:
Pr-SH + LJ LH + Pr-SJ,
Pr1-SJ + Pr2-SJ Pr1-SS-Pr2 ,
Pr-SJ + O2 Pr-SO2J
молекулярные производные.
Связанное с перекисным окислением липидов окисление белков и образование белковых агрегатов в хрусталике глаза заканчиваются его помутнением. Этот процесс играет важную роль в развитии старческой и других видов катаракты у человека. Большую роль в патологии клетки играет также инактивация ион-транспортных ферментов, в активный центр которых входят тиоловые группы, в первую очередь Ca2 +-АТФазы [6]. Инактивация этого фермента приводит к замедлению откачивания ионов кальция из клетки и, наоборот, к входу кальция в клетку, увеличению внутриклеточной концентрации ионов кальция и повреждению клетки. Наконец, окисление тиоловых групп мембранных белков приводит к появлению дефектов в липидном слое мембран клеток и митохондрий. Под действием разности электрических потенциалов на мембранах через такие поры в клетки входят ионы натрия, а в митохондрий - ионы калия. В результате происходят увеличение осмотического давления внутри клеток и митохондрий и их набухание. Это приводит к еще большему повреждению мембран.
Второй результат перекисного окисления липидов связан с тем, что продукты пероксидации обладают способностью непосредственно увеличивать ионную проницаемость липидного бислоя. Так, показано, что продукты перекисного окисления липидов делают липидную фазу мембран проницаемой для ионов водорода и кальция. Это приводит к потере митохондриями способности осуществлять синтез АТФ, и клетка оказывается в условиях энергетического голода. Одновременно в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры.
Третий (и, быть может, самый важный) результат пероксидации - это уменьшение стабильности липидного слоя, что может привести к электрическому пробою мембраны собственным мембранным потенциалом, то есть под действием разности электрических потенциалов, существующей на мембранах живой клетки. Электрический пробой приводит к полной потере мембраной ее барьерных функций [7].
