
- •1. Предмет и задачи биофизики
- •2. Термодинамика
- •3.Биоэнергетика.
- •Электронная схема жизни
- •Трансмембранный электрохимический потенциал – унифицированная форма энергии в клетке
- •Принцип энергетического сопряжения.
- •Законы биоэнергетики.
- •Третий закон биоэнергетики
- •Общая схема энергетических преобразований в клетке Молекулярные механизмы процессов энергетического сопряжения - хемиосмотическая теория Митчела
- •Химические свойства
- •[Править]Роль в организме
- •Пути синтеза
- •Энергетика фотосинтеза
- •Уникальность фотосинтеза как физико-химического процесса.
- •4. Кинетика биологических процессов Кинетическая классификация химических реакций. Типы реакций.
- •Кинетические признаки, лежащие в основе различий простой и сложной реакций
- •Типы простых мономолекулярных и бимолекулярных реакций
- •Особенности кинетики биологических процессов
- •Скорость реакции
- •Зависимость скорости реакции от температуры.
- •Уравнение Аррениуса
- •График Аррениуса для биологических процессов
- •2. Обменно-резонансный.
- •3. Экситонный механизм.
- •Индуктивно-резонансный перенос
- •Что такое свободные радикалы?
- •Классификация свободных радикалов, образующихся в нашем организме
- •Биологические последствия пероксидации липидов
- •9. Биофизика фотобиологических процессов Фотобиологические процессы. Классификация фотобиологических процессов.
- •Участие пигментов в преобразовании энергии квантов
- •Зрение: строение зрительной клетки. Родопсин, фотопревращение родопсина
- •Фотодеструктивные процессы. Их общая характеристика.
- •10. Молекулярная биофизика.
- •Уровни структурной организации белков:
- •Роль слабых взаимодействий ближнего и дальнего порядка в самоорганизации белковой молекулы
- •Структурные и энергетические факторы, определяющие динамическую подвижность белков, потенциал Леннард-Джонса.
- •Конформационные изменения в белке
- •Ферме́нты
- •Ферментативный катализ
- •Электронно-конформационные взаимодействия
- •11. Биофизика механохимических процессов.
- •12.Биофизика мембранных процессов.
- •Мембрана как универсальный компонент биологических систем.
- •Плазматическая мембрана, химический состав биологических мембран
- •Классификация, принципы построения и характеристика мембранных липидов
- •Модельные липидные системы: монослои, мицеллы, липосомы.
- •Фазовые переходы липидов, температура фазового перехода
- •Молекулярная подвижность липидов: сегментарная, вращательная, латеральная, флип-флоп переходы
- •13. Функции биомембран Барьерная функция биомембран
- •Транспорт веществ через биомембраны
- •Движущие силы мембранного транспорта
- •Классификация транспорта веществ через мембраны
- •Механизмы пассивного мембранного транспорта
- •Уравнение Фика
- •Электродиффузионное уравнение Нэрнста-Планка
- •Ионный транспорт через каналы
- •Ионофоры
- •Облегчённая диффузия
- •Транспорт глюкозы в эритроцит
- •Активный транспорт
- •14. Электрические явления в мембранах Ионные токи через возбудимую мембрану
- •Стационарный потенциал Гольдмана-Ходжкина-Катца
- •Изменение мембранного потенциала при возбуждении, потенциал действия.
- •Распространение потенциала действия по нервному волокну
- •Роль локальных токов в распространении пд
- •15. Молекулярные механизмы рецепторных процессов Общая ха-ка процессов передачи информации в клетке: первичные мессенджеры, взаимодействия эффектор-рецептор, пути трансдукции рецепторного сигнала
- •Виды внутриклеточной сигнализации: аденилатциклазный и фосфоинозитидный пути трансдукции рецепторного сигнала
- •Вторичные мессенджеры
Скорость реакции
Скорость реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
![]()
выражение для скорости будет выглядеть так:
![]() .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Зависимость скорости реакции от температуры.
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Различают
среднюю скорость ![]()
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак ( - ) – что вещество расходуется в ходе реакции.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
![]() (3.9)
(3.9)
где![]() -
скорости реакции при Т1 и
Т2;
γ – термический коэффициент скорости
химической реакции
-
скорости реакции при Т1 и
Т2;
γ – термический коэффициент скорости
химической реакции ![]()
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.
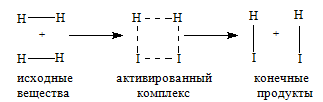
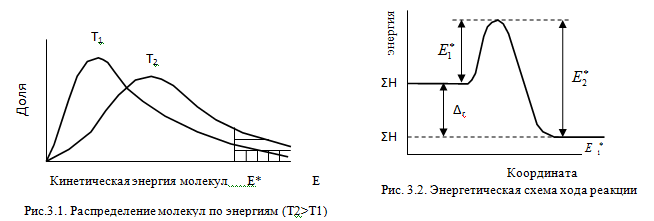
Изменение
энергии в ходе химической
реакции показано схемой процесса
активации (рис.3.2). По оси ординат отложена
потенциальная энергия системы. Абсцисса
- координата реакции или реакционного
пути. В процессе химического превращения
переход системы из начального состояния
с энергией ΣНi в конечное состояние с
ΣНf происходит через энергетический
барьер ![]() .
.
Энергия
активации (Е*) -
это энергия, необходимая для перевода
в состояние активированного комплекса
1 моль реагирующих веществ. Разность
ΣНf - ΣНi составляет тепловой эффект
реакции (ΔrH). Для обратной реакции
тепловой эффект будет иметь ту же
величину, но противоположный знак. Для
обратной реакции энергия активации
составит величину. ![]()
Зависимость
константы скорости химической реакции
от температуры описывается уравнением
Аррениуса: ![]() (3.10)
(3.10)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура , К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
