- •Завдання технології проектування вибір фізико хімічних умов і розробка схем виробництво процеси.
- •2)Реактори гетерогенно-каталітичних процесів.
- •1Хіміко технологічний процес і його зміст
- •2)Реактори для некаталітичних гетерогенних процесів
- •2Технологічні характеристики роботи реакторів
- •1Основні техніко економічні показники хіміко технологічних процесів
- •2)Основні показники роботи хімічних реакторів.
- •1. Поняття про швидкість хіміко технологічного процесу
- •1 Принципи складання матеріальних балансів
- •2)Переваги контактних апаратів кш.
- •1 Принципи складання теплових балансів
- •2)Недоліки роботи контактних апаратів з фільт. Шаром каталізатора.
- •1Принципи складання енергетичних балансів
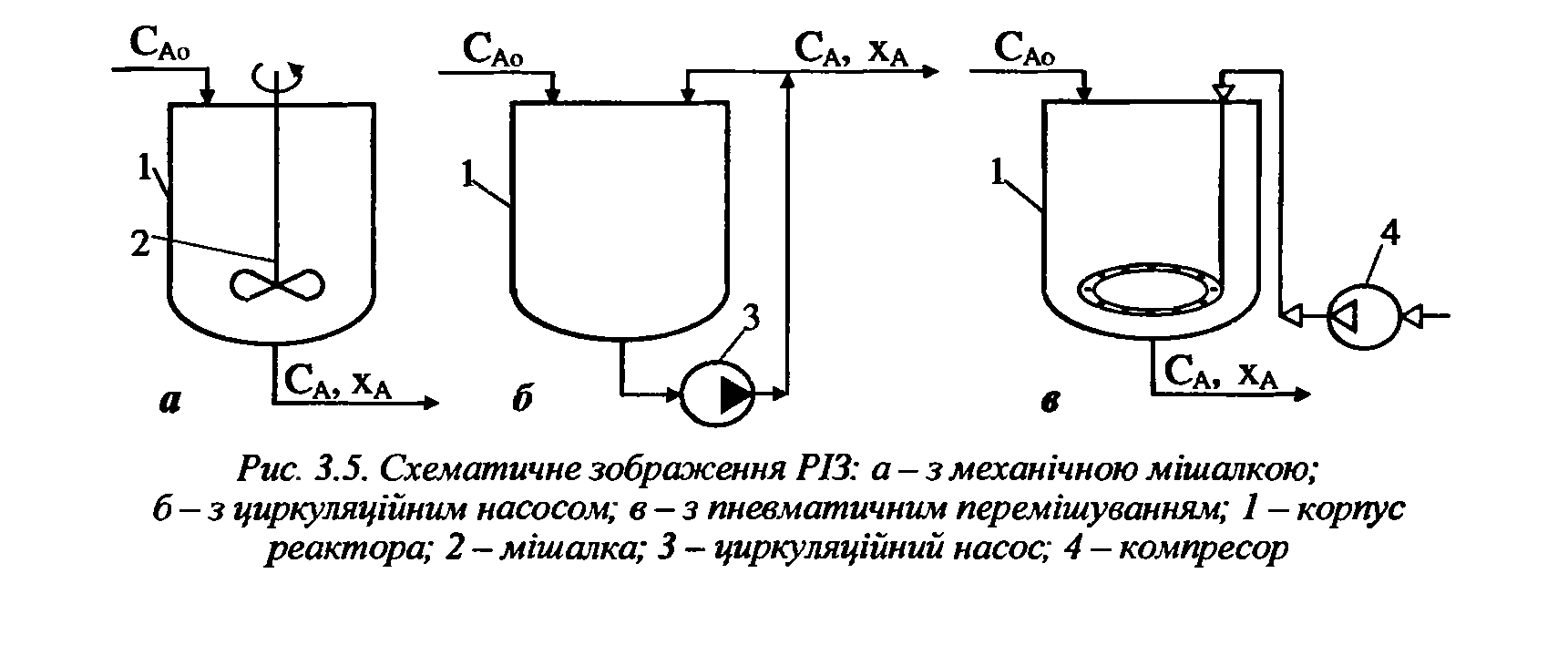
- •2)Характеристика реакторів змішування
- •Барбота жні реактори із суцільним барботажним шаром. 1-корпус, 2-грати.
- •1. Основні стадії проходження хіміко-технологічних процесів. Поняття про лімітуючі стадії.
- •2) ) Загальна характеристика реакторів для гомогенних процесів системи рідина-рідина. Апаратурне оформлення .
- •Способи виявлення лімітуючої стадії . Способи інтенсифікації процесів
- •2)Типові промислові реактори періодичної і неперервної дії! принципи організації теплообміну.
- •2)Вимоги,що ставляться до реакторів!
- •Каталізатори. Механізм дії каталізатор
- •Загальна характеристика хтс. Поняття про хтс. Основні типи зв’язків між Елементами хтс.
2)Характеристика реакторів змішування



Білет 11
Поняття про термодинамічні характеристики процесів. Термодинаміка – це наука про перетворення енергії. Поняття «енергія» пов’язане з рухом матерії: енергія є мірою руху матерії. Найбільш важливі поняття термодинаміки – це «теплота процесу» і «робота». Перетворення теплоти в роботу або роботи в теплоту здійснюються в термодинамічному процесі при участі робочого тіла. Термодинамічна система називається однорідною, якщо в усіх частинах системи властивості однакові. Сукупність фізичних властивостей робочого тіла (або термодинамічної системи) називається станом тіла (або системи). Величини, які характеризують стан термодинамічної системи називаються термодинамічними параметрами. До таких відносять: температура, тиск, питомий об’єм, густина, питома внутрішня енергія тощо. Термодинамічні параметри поділяють на екстенсивні та інтенсивні. Величини, які пропорційні масі робочого тіла або термодинамічної системи називаються екстенсивними (це об’єм, внутрішня енергія, ентальпія, ентропія тощо). Інтенсивні величини не залежать від маси термодинамічної системи, і тільки вони служать термодинамічними параметрами стану – це температура, тиск, а також екстенсивні величини, які віднесені до одиниці маси, об’єму або кількості речовини. Зміна інтенсивності параметрів з метою прискорення ХТП називається інтенсифікацією.
Характеристика роботи полі термічних реакторів.Політермічними називаються реактори, в яких відбувається часткове тепловідведення або теплопідведення за допомогою теплообмінних елементів відповідно до заданої програми зміни температури. Це РІВ, РІЗ- П.
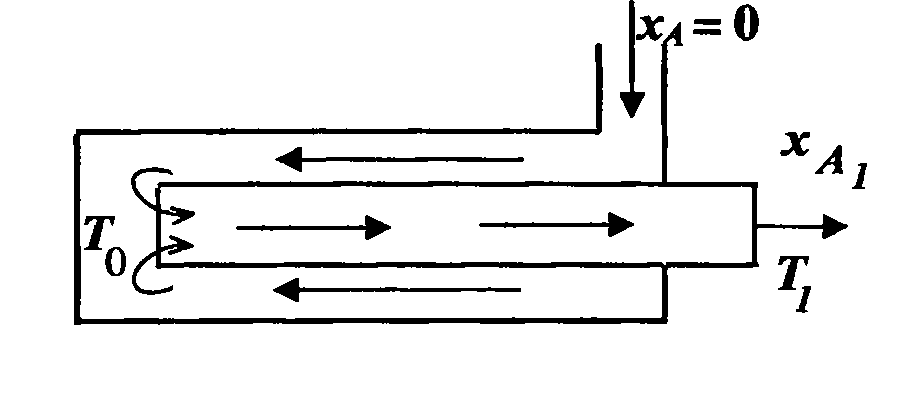
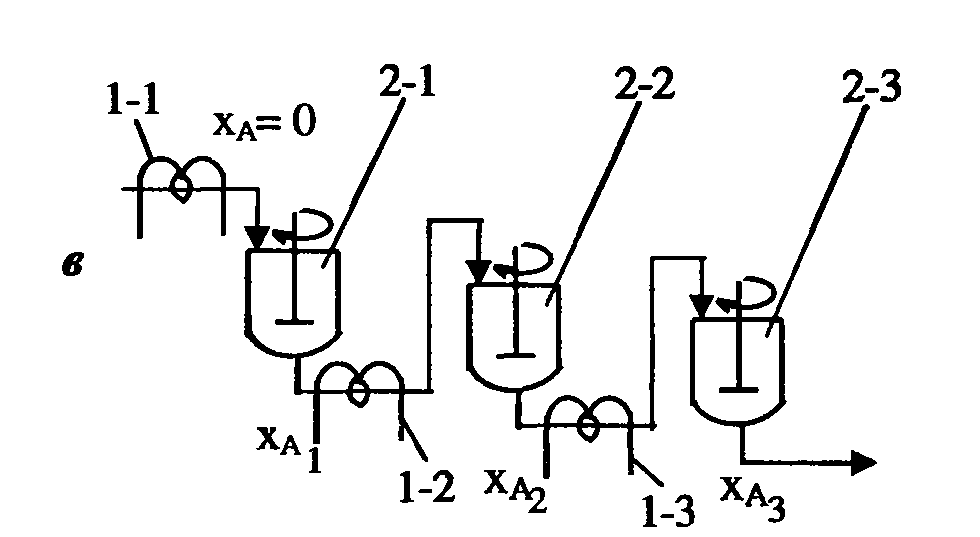
Реактор витіснення
![]()
Білет 12
.1 Кількісно стан хімічної рівноваги, що є відношенням добутку рівноважних концентрацій продуктів реакції до добутку концентрації вихідних речовин у степенях , що відповідають їх стехіометричним коефіцієнтам у рівнянні реакції.
За значенням const рівноваги хімічної реакції і складом вихідних реакцій суміші можна визначити склад суміші після реакції та ступінь перетворення вихідних речовин.
Згідно з законом діючих мас швидкість хім реакції пропорційна добутку кількості реагуючої речовини.
так для реакціїї : аА + вВ ↔ rR + sS +_ Q
Швидкість прямої і зворотної реакції пишеться так : U1 ↔ k1 Ca^a * CB^b
де К1 і К2 - const швидкості прямої і оборотної реакції
U2 → K2 Cr Cs
Консистенція рівноваги розраховується як відношення const швидкості прямої реакції до зворотної в момент рівноваги коли
Служить тільки для реакцій в умовах хімічної рівноваги.
Позначення і розмірність const рівноваги залежить від того в яких одиницях виражається концентрація реагуючих речовин
Ks - якщо концентрація реагуючих речовин виражені моль
Кр - якщо концентрація реагуючих речовин виражена в парціальних тисках
Кn - якщо концентрація речовин виражена кількістю молей.
К - якщо концентрація реагуючих речовин виражена у молях а у випадку газів в об ємних частках.
2.Характеристика роботи ізотермічних реакторів.Ізотермічними називають реактори в яких процес відбувається за сталої температури в об’ємі реактора. Це досягається в РІЗ-Б завдяки підведенню чи відведенню теплоти реакції або внаслідок регулюванню температури суміші, що надходить у реактор. Ізотермічними можуть бути і РІВ за умов перебігу процесів у ньому з малими тепловими ефектами або з низькою концентрацією вихідних реагентів, та невисокому значенні ступеня перетворення. Ізотермічними ще є реактори в яких екзо- і ендотермічні процеси практично врівноважені
.
 Білет 13
Білет 13
Способи зміщення рівноваги хіміко-технологічних процесів. Для аналізу існуючих технологічних процесів чи під час розроблення нових, в яких відбуваються оборотні реакції необхідно вміти оцінювати вплив різних чинників на їх перебіг. Напрям зміни перебігу процесів , які відбуваються в рівноважній системі за зміни зовнішніх умов визначається принципом Ле-Шательє: Якщо система виведена з стану рівноваги дією зовнішнього фактора, то у системі відбуваються процеси, спрямовані на послаблення дії цього фактора. Температура – для зміщення рівноваги у бік цільових продуктів, треба підвищити температуру, тобто підводити теплоту. Тиск – вплив тиску на рівновагу оцінюють лише в тих випадках, коли хоча б один з компонентів рівноважної суміші є газоподібною речовиною. Для того, щоб визначити, як впливає тиск на рівновагу за стехіометричним рівнянням реакції визначають початковий і кінцевий об’єми системи, а для цього визначають кількість молів газоподібної речовини до і після реакції. Якщо реакція відбувається зі зменшенням газового об’єму, то для зміщення рівноваги в бік цільового продукту в цій системі треба підвищувати тиск. І навпаки, якщо реакція відбувається за сталого об’єму, то тиск на положення рівноваги не впливає. Концентрація – коли концентрація реагуючих речовин на рівновагу введення будь-якої з речовин, які присутні в системі у стані рівноваги є зовнішнім чинником, дією якого система прагне зменшити , внаслідок чого рівновага зміститься в той чи інший бік: якщо вводиться вихідний реагент, то праворуч, а продукту – ліворуч. Зі зміною концентрації в бік продукту є його виведення із реакційного середовища, або збільшувати концентрацію реагентів, бажано дешевшого.
Білет 14
Залежність константи рівноваги від температури. Вплив температури на рівновагу в хім. Системі - У системі, якій пряма реакція є екзотермічною у стані рівноваги швидкість прямої і зворотної реакції є однакові, відповідно кількість теплоти, яка виділиться, дорівнює кількості теплоти, що поглинається. Якщо у такій рівноважній системі збільшувати температуру, тобто вводити ззовні додаткову кількість енергії у формі теплоти, то система намагається протидіяти цій дії, вона послаблює зовнішній вплив, тобто зменшує загальну кількість теплоти у системі, поглинаючи її частини. Отже, для зміщення рівноваги у бік цільового продукту треба зменшити температуру в системі відводячи теплоту за допомогою теплоносія. У системі, якій пряма реакція є ендотермічною, то для зміщення рівноваги у бік цільових продуктів, треба підвищити температуру, тобто підводити теплоту.
. Р-ри для системи газ-тверда речовина.Процесами зв участю системи Г-Т є адсорбція газів твердими сорбентами, і десорбція,сублімація і конденсація парів твердих речовин, піроліз твердого палива…Різні види випалюваття тв..матеріалу(найхарактерніше).Під час випалювання інколи відбувається плавлення(топлення) тв..матеріалу, у наслідок чогозявляється рідка фаза,яка може взаємодіяти з іншими компонентами гетерогенної системи.Газова фаза,що утворюється при піролізу і випалюванню, служить не лише реагентом, але й теплоносієм,або охолоджуючим агентом.Переважна більшість некаталітичних процесів відбувається за рахунок високих температур, томі відповідні хімічні реактори мають назву печі.
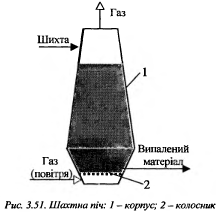 Білет 15
Білет 15
Поняття про термодинамічний аналіз. Про проектування технологічних процесів важливе значення мають термодинамічні розрахунки хімічних реакцій. Вони дозволяють зробити висновки про можливості даного хімічного перетворення, попередньо вибрати умови проведення процесу, визначити рівноважний стан продуктів, розрахувати теоретичний ступінь перетворення вихідних речовин і вихід продуктів, енергетичні ефекти, що необхідно для складання енергетичних балансів і визначення енергетичних затрат.
46.Р-ри для системи рідина-тверда речовина.Більшість процесів відбуваються у дифузійній області, тому використовують для інтенсифікації :збільшення відносної лінії швидкості руху фаз (перемішування), збільшення площі поверхні руху фаз(подрібнення тв..сировини).Реактори поділяються залежно від того, як інтенсифікують процес, на такі, як:- забезпечується висока лінійна швидкість рідини відносно твердої фази;(Ап з ФШ і КШ)- перемішування системи Р-Т.
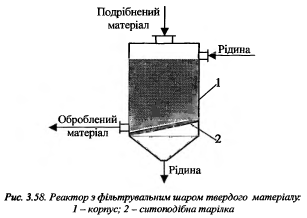
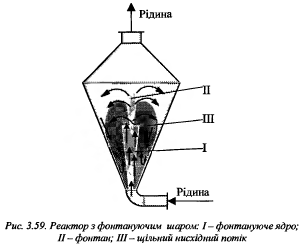
Якщо різниця між густинами фаз є невелика, використовують р-ри з фонтануючим шаром
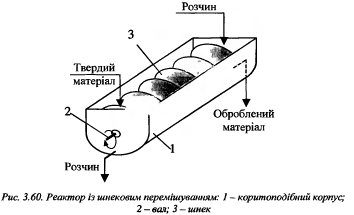
Білет 16
Гомогенні і гетерогенні хіміко-технологічні процеси. Гомогенними називають процеси, що відбуваються в однорідному середовищі, рідині або газоподібній суміші, в якій поверхня розділу між окремими їх частинами або компонентами відсутні. Гомогенні процеси в промисловості зустрічаються доволі рідко. Справді гомогенну систему отримати важко. Будь-яка речовина містить сліди різних домішок, що знаходиться в іншій фазі. У гомогенних процесах реакція відбувається в об’ємі, як правило, значно швидше, ніж у гетерогенних. Здійснення і керування технологічними гомогенними процесами є значно простішими і легшими, тому багато промислових гетерогенних процесів намагаються перевести в гомогенні. При протіканні більшості промислових ХТП реагенти знаходяться в різних фазах. Такі процеси називають гетерогенними. Найбільш поширені гетерогенні процеси, коли реагуючі речовини знаходяться в таких сполученнях фазових станів: Газ-рідина, газ-тверда речовина, рідина-тверда речовина, тверда речовина-тверда речовина, газ-рідина-тверда речовина.
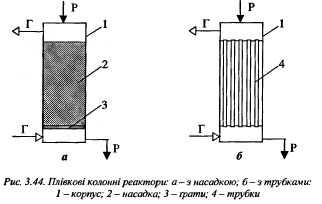
.Р-ри для некаталітичних гетерогенних процесів, системи газ-рідина.Для здійснення гетерогенних процесів в системі газ-рідина використовують обладнання, в якому не тільки хімічні але й фізичні, масообмінні та теплообмінні процеси.Залежно від конструкції, режиму руху розрізняють : колонні (барботажні, плівкові, з розпилюванням рідини), трубчасті, пінні реактори. За режимом руху фаз : прямотечійні, протитечій ні, із перехресним рухом фаз.