
- •Вопрос 1
- •2 Вопрос
- •[Править]Природа
- •[Править]История
- •[Править]Свойства
- •[Править]в воде [править]Механизм Гротгуса
- •[Править]Водные кластеры
- •[Править]в нуклеиновых кислотах и белках
- •Ковалентная связь.
- •Химическая связь. Основные характеристики химической связи
- •Ковалентная связь
- •Полярная и неполярная ковалентная связь
- •Водородная связь
- •3 Вопрос
- •Основы методов валентных связей (вс) и молекулярных орбиталей (мо)
- •4 Вопрос
- •[Править]Проявления периодического закона в отношении энергии ионизации
- •[Править]Проявления периодического закона в отношении энергии сродства к электрону
- •[Править]Проявления периодического закона в отношении электроотрицательности
- •[Править]Проявления периодического закона в отношении атомных и ионных радиусов
- •[Править]Проявления периодического закона в отношении энергии атомизации
- •[Править]Проявления периодического закона в отношении степени окисления
- •[Править]Проявления периодического закона в отношении окислительного потенциала
- •[Править]Внутренняя и вторичная периодичность [править]s- и р-элементы
- •[Править]d-Элементы
- •5 Вопрос
- •Общие свойства растворов Качественный и количественный состав растворов
- •Массовая доля и молярная концентрация растворённого вещества
- •Теоретическая часть
- •6 Вопрос
- •[Править]Основные термины
- •[Править]Классификация
- •[Править]По заряду комплекса
- •[Править]По числу мест занимаемых лигандами в координационной сфере
- •[Править]По природе лиганда
- •[Править]Номенклатура
- •[Править]История
- •[Править]Структура и стереохимия
- •[Править]Изомерия координационных соединений
- •[Править]Пространственная (геометрическая) изомерия
- •[Править]Оптическая изомерия
- •[Править]Электронные свойства [править]Окраска
- •[Править]Магнитные свойства
- •[Править]Применение
- •1. 1. Основные понятия координационной теории вернера
- •1. 2. Определение заряда основных частиц комплексного соединения
- •1. 3. Номенклатура комплексных соединений
- •Координационная теория Вернера
- •8 Вопрос
- •[Править]Скорость химической реакции
- •[Править]Порядок химической реакции
- •[Править]Реакция нулевого порядка
- •[Править]Реакция первого порядка
- •[Править]Реакция второго порядка
- •[Править]Молекулярность реакции
- •[Править]Катализ
- •§ 1.4. Скорость химической реакции. Кинетическое уравнение и константа скорости. Закон действующих масс.
- •10 Вопрос
- •5.3. Порядок химических реакций
- •2.1.5 Методы определения порядка реакции
- •2.1.6 Молекулярность элементарных реакций
- •11 Вопрос
- •Зависимость константы равновесия от температуры
- •[Править]Константа равновесия и константа скорости реакции
- •[Править]Методы расчета константы равновесия
- •[Править]Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
- •12 Вопрос
- •# Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
- •# Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
- •[Править]Определение
- •[Править]Связь с термодинамической устойчивостью системы
- •[Править]Применение в химии [править]Связь с химическим потенциалом
- •[Править]Энергия Гиббса и направление протекания реакции
- •[Править]Историческая справка
- •Основные типы гибридизации атомных орбиталей комплексообразователей и соответствующие им геометрические формы комплексов
- •Природа химической связи в комплексных соединениях. Вторичная диссоциация комплексов. Константа нестойкости
- •[Править]Основные принципы катализа
- •[Править]Типы катализа
- •[Править]Гомогенный катализ
- •[Править]Гетерогенный катализ
- •[Править]Носитель катализатора
- •[Править]Химия катализа
- •Растворы неэлектролитов
- •[Править]Отклонения от закона Рауля
- •[Править]Второй закон Рауля
- •[Править]Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •Законы Рауля
- •[Править]Выбор стандартного состояния
- •[Править]Методы определения активности
- •[Править]По равновесному давлению пара
- •[Править]По повышению температуры кипения раствора
- •[Править]По понижению температуры замерзания раствора
- •[Править]По осмотическому давлению раствора
- •[Править]Пример
- •[Править]Методы определения
- •[Править]Мнимая степень диссоциации
- •[Править]История
- •[Править]Уравнения, связывающие pH и pOh [править]Вывод значения pH
- •[Править]pOh
- •[Править]Значения pH в растворах различной кислотности
- •[Править]Методы определения значения pH
- •[Править]Роль pH в химии и биологии
- •Формы применения индикаторов
- •[Править]Кислотно-основные индикаторы (водные растворы) [править]Интервалы перехода цвета индикаторов
- •26 Вопрос
- •[Править]История становления понятия
- •[Править]Модели атомов
- •[Править]Квантово-механическая модель атома
- •[Править]Строение [править]Субатомные частицы
- •[Править]Электроны в атоме
- •[Править]Свойства
- •[Править]Масса
- •[Править]Размер
- •[Править]Радиоактивный распад
- •[Править]Магнитный момент
- •[Править]Энергетические уровни
- •[Править]Валентность
- •[Править]Гидролиз солей
- •[Править]Степень гидролиза
- •[Править]Константа гидролиза
- •[Править]Гидролиз органических веществ
- •[Править]Измерение потенциалов
- •Решение типовых задач по теме “основы электрохимии” (для нехимических специальностей)
- •[Править]Первый закон Фарадея
- •[Править]Вывод закона Фарадея
- •[Править]Второй закон Фарадея
- •[Править]Изменение электролизом веществ
- •[Править]Примеры [править]Расплавы
- •[Править]Растворы
- •[Править]Мнемоническое правило
- •[Править]Описание
- •[Править]Окисление
- •[Править]Восстановление
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •[Править]Мнемонические правила
- •[Править]История
- •[Править]Основные положения
- •[Править]Вытекающие законы и положения
- •Стехиометрические законы
- •1.1.1 Количество вещества - моль вещества
- •1.1.2 Эквивалентная масса (молярная масса эквивалента вещества)
- •Метод валентных связей
- •Обратимая окислительно-восстановительная система
- •[Править]Закон эквивалентов
- •[Править]Определение
- •[Править]Диссоциация электролитов с многовалентными ионами
- •[Править]Связь константы диссоциации и степени диссоциации
- •[Править]Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
- •[Править]Константа диссоциации сильных электролитов
- •[Править]Примеры расчётов [править]Диссоциация воды
- •[Править]Диссоциация слабой кислоты
- •[Править]Пример
- •[Править]Методы определения
- •[Править]Мнимая степень диссоциации
- •Кислотность и основность по Бренстеду-Лоури
[Править]Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
все вещества реагируют в эквивалентных отношениях.
формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Электрохимический эквивалент — количество вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества:
где
 — постоянная
Фарадея.
— постоянная
Фарадея.Постоя́нная Фараде́я , — физическая постоянная, определяющая соотношение между электрохимическими и физическими свойствами вещества.
Постоянная Фарадея равна
 Кл·моль−1.
Кл·моль−1.Постоянная Фарадея входит в качестве константы во второй закон Фарадея (закон электролиза).
Численно постоянная Фарадея равна электрическому заряду, при прохождении которого через электролит на электроде выделяется (1/z) моль вещества A в формуле:
 где:
где: 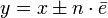 —
количество электронов, участвующих в
ходе реакции.
—
количество электронов, участвующих в
ходе реакции.Для постоянной Фарадея справедливо следующее соотношение:
 ,
,где
 — элементарный
заряд,
а
— элементарный
заряд,
а  — число
Авогадро.
— число
Авогадро.
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левогоиндекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий,актинон).
Пример изотопов: 168O, 178O, 188O — три стабильных изотопа кислорода.
Содержание [убрать]
|
[править]Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
[править]История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распадатория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
[править]Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
[править]Применение изотопов человеком
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235Uспособен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов, процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
![]()
где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
-
Содержание
[убрать]
1 Определение
2 Диссоциация электролитов с многовалентными ионами
3 Связь константы диссоциации и степени диссоциации
4 Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
5 Константа диссоциации сильных электролитов
6 Примеры расчётов
6.1 Диссоциация воды
6.2 Диссоциация слабой кислоты
7 См. также
