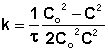- •Вопрос 1
- •2 Вопрос
- •[Править]Природа
- •[Править]История
- •[Править]Свойства
- •[Править]в воде [править]Механизм Гротгуса
- •[Править]Водные кластеры
- •[Править]в нуклеиновых кислотах и белках
- •Ковалентная связь.
- •Химическая связь. Основные характеристики химической связи
- •Ковалентная связь
- •Полярная и неполярная ковалентная связь
- •Водородная связь
- •3 Вопрос
- •Основы методов валентных связей (вс) и молекулярных орбиталей (мо)
- •4 Вопрос
- •[Править]Проявления периодического закона в отношении энергии ионизации
- •[Править]Проявления периодического закона в отношении энергии сродства к электрону
- •[Править]Проявления периодического закона в отношении электроотрицательности
- •[Править]Проявления периодического закона в отношении атомных и ионных радиусов
- •[Править]Проявления периодического закона в отношении энергии атомизации
- •[Править]Проявления периодического закона в отношении степени окисления
- •[Править]Проявления периодического закона в отношении окислительного потенциала
- •[Править]Внутренняя и вторичная периодичность [править]s- и р-элементы
- •[Править]d-Элементы
- •5 Вопрос
- •Общие свойства растворов Качественный и количественный состав растворов
- •Массовая доля и молярная концентрация растворённого вещества
- •Теоретическая часть
- •6 Вопрос
- •[Править]Основные термины
- •[Править]Классификация
- •[Править]По заряду комплекса
- •[Править]По числу мест занимаемых лигандами в координационной сфере
- •[Править]По природе лиганда
- •[Править]Номенклатура
- •[Править]История
- •[Править]Структура и стереохимия
- •[Править]Изомерия координационных соединений
- •[Править]Пространственная (геометрическая) изомерия
- •[Править]Оптическая изомерия
- •[Править]Электронные свойства [править]Окраска
- •[Править]Магнитные свойства
- •[Править]Применение
- •1. 1. Основные понятия координационной теории вернера
- •1. 2. Определение заряда основных частиц комплексного соединения
- •1. 3. Номенклатура комплексных соединений
- •Координационная теория Вернера
- •8 Вопрос
- •[Править]Скорость химической реакции
- •[Править]Порядок химической реакции
- •[Править]Реакция нулевого порядка
- •[Править]Реакция первого порядка
- •[Править]Реакция второго порядка
- •[Править]Молекулярность реакции
- •[Править]Катализ
- •§ 1.4. Скорость химической реакции. Кинетическое уравнение и константа скорости. Закон действующих масс.
- •10 Вопрос
- •5.3. Порядок химических реакций
- •2.1.5 Методы определения порядка реакции
- •2.1.6 Молекулярность элементарных реакций
- •11 Вопрос
- •Зависимость константы равновесия от температуры
- •[Править]Константа равновесия и константа скорости реакции
- •[Править]Методы расчета константы равновесия
- •[Править]Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
- •12 Вопрос
- •# Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
- •# Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
- •[Править]Определение
- •[Править]Связь с термодинамической устойчивостью системы
- •[Править]Применение в химии [править]Связь с химическим потенциалом
- •[Править]Энергия Гиббса и направление протекания реакции
- •[Править]Историческая справка
- •Основные типы гибридизации атомных орбиталей комплексообразователей и соответствующие им геометрические формы комплексов
- •Природа химической связи в комплексных соединениях. Вторичная диссоциация комплексов. Константа нестойкости
- •[Править]Основные принципы катализа
- •[Править]Типы катализа
- •[Править]Гомогенный катализ
- •[Править]Гетерогенный катализ
- •[Править]Носитель катализатора
- •[Править]Химия катализа
- •Растворы неэлектролитов
- •[Править]Отклонения от закона Рауля
- •[Править]Второй закон Рауля
- •[Править]Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •[Править]Криоскопическая и эбулиоскопическая константы
- •[Править]Растворы электролитов
- •Законы Рауля
- •[Править]Выбор стандартного состояния
- •[Править]Методы определения активности
- •[Править]По равновесному давлению пара
- •[Править]По повышению температуры кипения раствора
- •[Править]По понижению температуры замерзания раствора
- •[Править]По осмотическому давлению раствора
- •[Править]Пример
- •[Править]Методы определения
- •[Править]Мнимая степень диссоциации
- •[Править]История
- •[Править]Уравнения, связывающие pH и pOh [править]Вывод значения pH
- •[Править]pOh
- •[Править]Значения pH в растворах различной кислотности
- •[Править]Методы определения значения pH
- •[Править]Роль pH в химии и биологии
- •Формы применения индикаторов
- •[Править]Кислотно-основные индикаторы (водные растворы) [править]Интервалы перехода цвета индикаторов
- •26 Вопрос
- •[Править]История становления понятия
- •[Править]Модели атомов
- •[Править]Квантово-механическая модель атома
- •[Править]Строение [править]Субатомные частицы
- •[Править]Электроны в атоме
- •[Править]Свойства
- •[Править]Масса
- •[Править]Размер
- •[Править]Радиоактивный распад
- •[Править]Магнитный момент
- •[Править]Энергетические уровни
- •[Править]Валентность
- •[Править]Гидролиз солей
- •[Править]Степень гидролиза
- •[Править]Константа гидролиза
- •[Править]Гидролиз органических веществ
- •[Править]Измерение потенциалов
- •Решение типовых задач по теме “основы электрохимии” (для нехимических специальностей)
- •[Править]Первый закон Фарадея
- •[Править]Вывод закона Фарадея
- •[Править]Второй закон Фарадея
- •[Править]Изменение электролизом веществ
- •[Править]Примеры [править]Расплавы
- •[Править]Растворы
- •[Править]Мнемоническое правило
- •[Править]Описание
- •[Править]Окисление
- •[Править]Восстановление
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •[Править]Мнемонические правила
- •[Править]История
- •[Править]Основные положения
- •[Править]Вытекающие законы и положения
- •Стехиометрические законы
- •1.1.1 Количество вещества - моль вещества
- •1.1.2 Эквивалентная масса (молярная масса эквивалента вещества)
- •Метод валентных связей
- •Обратимая окислительно-восстановительная система
- •[Править]Закон эквивалентов
- •[Править]Определение
- •[Править]Диссоциация электролитов с многовалентными ионами
- •[Править]Связь константы диссоциации и степени диссоциации
- •[Править]Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
- •[Править]Константа диссоциации сильных электролитов
- •[Править]Примеры расчётов [править]Диссоциация воды
- •[Править]Диссоциация слабой кислоты
- •[Править]Пример
- •[Править]Методы определения
- •[Править]Мнимая степень диссоциации
- •Кислотность и основность по Бренстеду-Лоури
2.1.5 Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
Порядок реакции |
Зависимость концентрации от времени |
1 |
|
2 |
|
3 |
|
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
Порядок реакции |
Выражение для константы скорости |
1 |
|
2 |
|
3 |
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
Порядок реакции |
Выражение для периода полупревращения |
1 |
|
2 |
|
3 |
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.
2.1.6 Молекулярность элементарных реакций
Элементарными (простыми) называют реакции, идущие в одну стадию. Их принято классифицировать по молекулярности:
Молекулярность элементарной реакции – число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
I2 ––> I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН ––> СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ––> 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Тем не менее, никакой чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции не существует, поскольку порядок реакции характеризует кинетическое уравнение реакции, а молекулярность – механизм реакции.
Посмотреть прак