
- •Опухоли, характеристика опухолевого роста
- •Эпидемиология опухолевых заболеваний
- •Методы экспериментального моделирования опухолей
- •Биологические особенности опухолей
- •Этиология опухолей
- •Значение условий в возникновении и развитии опухолей
- •Патогенез опухолевого роста
- •Современные представления о патогенезе опухолевого роста
- •Взаимоотношение опухоли и организма
- •Опухолевые маркёры
- •Противоопухолевая защита организма
- •Нервная система и развитие опухоли
- •Эндокринная система и развитие опухоли
- •Предраковые состояния
- •Основные принципы профилактики и терапии опухолей
Патогенез опухолевого роста
Клетка под воздействием канцерогена претерпевает ряд последовательных изменений, которые приводят к опухолевому росту. Механизм развития опухолевого роста называют канцерогенезом.
Эволюция представлений о патогенезе опухолевого роста.
1. Мутационная концепция канцерогенеза состоит в том, что в основе превращения нормальной клетки в опухолевую клетку находятся мутации: генные, хромосомные или геномные. О возможной роли мутационных механизмов в канцерогенезе свидетельствуют следующие факты: мутагенность большинства известных канцерогенов (90%) и канцерогенность большинства известных мутагенов (у 85-87%); обнаружение в клетках некоторых опухолей маркёрных хромосом (например, укорочение длинного плеча хромосомы 22, филадельфийская хр. – маркёр хронического миелолейкоза у человека); значительное увеличение заболеваемости лейкозом и другими опухолями (в 20-50 раз) у людей, имеющих генетические дефекты (например, болезнь Дауна, синдром Клайнфельтера и др.).
2. Эпигеномная концепция канцерогенеза. В основе превращения нормальной клетки в злокачественную лежат нарушения регуляции генной активности, а не нарушения генетического аппарата. Под влиянием канцерогенов в клетке происходит сдвиг в регуляции генной активности: дерепрессируются группы генов, которые в норме должны быть репрессированы или блокируются гены, которые должные быть активными. В результате клетка становится нечувствительной к регуляторным влияниям целостного организма. Эпигеномная концепция канцерогенеза объясняет ряд особенностей опухолей: антигенная реверсия; выработка некоторыми опухолями гормонов, не присущих клеткам гомологичной ткани.
3. Вирусо-генетическая концепция канцерогенеза. Опухолевая трансформация является результатом внесения в генетический материал клетки чужеродной генетической информации онкогенными вирусами. Внесенная вирусом новая генетическая информация изменяет характер роста и поведение клетки, трасформирует её в злокачественную.
Этапы вирусного канцерогенеза.
• Рецепция вируса. Взаимодействие вирусной частицы с определенными структурами плазматической мембраны клетки (рецепторами).
• Проникновение вируса в клетку (интернализация).
• Объединение (интеграция) вирусного генома с геномом клетки. Это центральный и обязательный этап вирусного онкогенеза. В случае ДНК-содержащих онковирусов происходит встраивание вирусной ДНК в ДНК клетки, в случае РНК-содержащих вирусов – встраивается ДНК-провирус, образующийся под влиянием обратной транскриптазы (ревертазы).
• Продукты вирусного онкогена нарушают регуляцию клеточного деления, что вызывает трансформацию клетки и превращение её в опухолевую.
Современные представления о патогенезе опухолевого роста
Опухоль возникает как следствие нарушения тканевого гомеостаза – усиленной клеточной пролиферации и/или сниженной клеточной гибели. В большинстве опухолей человека имеются оба механизма, которые дополняют друг друга.
В середине 80-х гг. прошлого столетия было доказано, что некоторые нормальные клеточные гены обладают онкогенным потенциалом. Так сформировалась концепция онкогена, возникающего из нормального гена (протоонкогена) при его повреждении тем или иным способом.
В основе превращения клетки в опухолевую лежат изменения особых генов: протоонкогенов (гены-активаторы клеточного деления) и антионкогенов (гены-супрессоры клеточного деления).
В нормальном состоянии эти гены играют ключевую роль в важнейших проявлениях жизнедеятельности клетки, осуществляя позитивный (протоонкогены) или негативный (антионкогены) контроль клеточного деления, а также участвуют в механизмах программируемой гибели клетки (апоптоз).
Мутации могут привести к усилению функций протоонкогенов (с превращением их в онкогены) и/или к инактивации функции антионкогенов. Такие изменения в геноме приводят клетку к опухолевой трансформации.
Протоонкогены – специфические гены нормальных клеток, которые осуществляют позитивный контроль процессов пролиферации. Они несут информацию о структуре белков, принимающих участие в регуляции клеточного деления.
Клеточные протоонкогены являются аналогами вирусных онкогенов. Считают, что вирусные онкогены представляют собой протоонкогены, попавшие в геном вирусов в результате длительной эволюции последних (это объясняется тем, что вирусы, проходя через клетки, могут «воровать», т.е. прихватывать с собой клеточные гены).
Протоонкогены имеются во всех клетках. Однако в одних клетках они всю жизнь репрессированы, т.е. «молчат», в других они «работают» только в период эмбриогенеза, а в остальных – функционируют в соответствии с поступающими регуляторными сигналами.
В настоящее время известно около сотни протоонкогенов. Нарушение функций протоонкогенов вызывает их превращение в онкогены и способствует опухолевой трансформации клетки.
Клеточные онкогены – это активные протоонкогены, которые приобрели способность трансформировать клетку, т.е. превращать её в опухолевую.
Активация онкогенов может происходить двумя путями – в результате дефекта регуляции их транскрипции или изменения «дозы» гена (при его амплификации), что приводит к избыточному синтезу соответствующего белка, не адекватному месту и времени. Таким образом, активация онкогена обусловлена нарушением его регуляции или структурной части.
Механизмы активации протоонкогена:
1. Генная (точковая) мутация протоонкогена.
2. Хромосомные аберрации:
• амплификация протоонкогенов (↑ числа протоонкогенов с подпороговой активностью);
• транслокация протоонкогена к локусу функционирующего промотора;
• транслокация функционирующего промотора к локусу протоонкогена;
3. Эпигеномные изменения:
• инсерция (вставка) вирусного промотора (ДНК-копии определенных участков ретровирусов к локусу протоонкогена);
• мутация регуляторных генов, репрессирующих активность протоонкогена.
Онкогены обозначают соответственно их нахождению: в вирусе (v - virus) или в клетке (c - cellula), а также по характеру опухоли (src, sis, myc, erb и т.д.). Например, v-src - вирус саркомы Рауса; c-myc - клеточный онкоген миелоцитарного лейкоза; c-erb - клеточный онкоген эритробластоза; v-sis - вирус саркомы обезьян и др.
Белки, кодируемые протоонкогенами – онкобелки, непосредственно участвуют в проведении ростстимулирующих сигналов, побуждающих клетку к делению (митогенное действие).
Виды и функции клеточных онкогенов. В зависимости от продуктов, информацию о которых несут онкогены, их делят на следующие группы (рис. 2).
1. Онкогены, кодирующие факторы роста или их аналоги (например, sis-онкоген вируса саркомы обезьян и аналогичный протоонкоген клеток кодируют структуру фактора роста тромбоцитарного происхождения).
2. Онкогены, кодирующие синтез рецепторов к факторам роста (например, онкоген вируса лейкоза кур erb-B несет информацию о видоизмененном рецепторе к эпидермальному фактору роста).
3. Онкогены, кодирующие синтез онкобелков вторичных мессенджеров факторов роста (например, ras-онкоген вируса саркомы крыс, несущий информацию о цитоплазматическом ГТФ-связывающем белке).
4. Онкогены, кодирующие синтез ядерных белков-регуляторов (например, mic-онкоген вируса миелоцитоза кур).
Антионкогены – гены-супрессоры клеточного деления. Их известно около двух десятков, они действуют как ингибиторы проведения рострегулирующих сигналов в клетке и тем самым предупреждают возможность нерегулируемой пролиферации.
Инактивация антионкогенов приводит к неконтролируемому росту клеток. Для выключения антионкогена необходимы две мутации в обоих его аллелях (так как антионкогены - рецессивны), тогда как для превращения протоонкогена в действующий онкоген достаточно только одной (доминантной) мутации.
Наличие первой мутации в одном из аллелей антионкогенов предрасполагает к возникновению опухоли, и если такой мутантный аллель унаследован, то достаточно второй мутации, чтобы произошла опухолевая трансформация (например, ретинобластома).
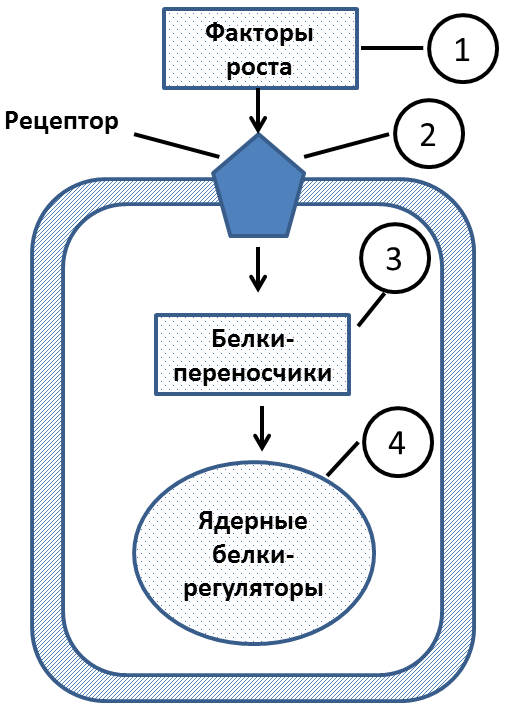
Рис. 2. Продукты онкогенов
Антионкогены – это клеточные гены, продукты которых вызывают репрессию протоонкогенов. Мутации антионкогенов, приводящие к образованию неактивных продуктов, могут иметь своим следствием дерепрессию протоонкогенов и трансформацию клетки, т.е. образование злокачественной опухоли. Антионкогены осуществляют роль негативных регуляторов прохождения клетки по клеточному циклу, конечным результатом которого является митоз.
Механизмы снижения активности антионкогенов: мутации антионкогенов (например, генов синтеза белка р53, Rb и др.); эпигеномная депрессия антионкогенов.
Приведём несколько примеров.
Как известно, клеточный цикл (рис. 3) разделяется на 4 дискретных временных периода: G1, S, G2 и М. В фазе S (синтетическая фаза) происходит репликация ДНК; фаза М - митоз; G1 и G2 - промежутки соответственно между М и S и между S и М.
Временной механизм прохождения клеткой этого цикла контролируется синтезом и распадом специальных белков – циклинов. Их экспрессия периодически возрастает в течение одной фазы клеточного цикла и затем снижается в другой фазе. Циклины образуют комплексы с циклинзависимыми протеинкиназами, что вызывает фосфорилирование нескольких белков, необходимых для вхождения клетки в S-фазу цикла.
Одним из таких белков является продукт антионкогена Rb, с инактивацией которого связано развитие ретинобластомы (опухоль сетчатки у детей) и наследственной формы остеосаркомы.
Когда белок Rb не фосфорилирован, он связан с транскрипционными факторами, которые отвечают за включение генов, регулирующих репликацию ДНК в S-фазе. Связь белка Rb с транскрипционными факторами лишает их активности, что препятствует вступлению клетки в фазу репликации ДНК (S-фазу клеточного цикла).
При фосфорилировании белка Rb транскрипционные факторы освобождаются и вызывают вступление клетки в S-фазу.
Таким образом, в норме антионкоген Rb осуществляет негативный контроль пролиферации, разрешая или не разрешая клеткам вхождение в фазу репликации ДНК (S-фаза клеточного цикла).
Утрата этой функции в результате инактивации антионкогена Rb (его мутации) приводит к тому, что транскрипционные факторы остаются несвязанными, и клетка безостановочно «пробегает» по циклу даже в тех случаях, когда действует запрет на пролиферацию.
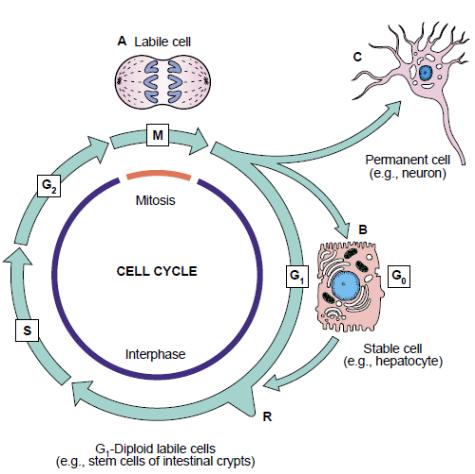
Рис. 3. Схема клеточного цикла
Другим антионкогеном, выполняющим в клетке рострегулирующую функцию, является антионкоген p53. Белок, кодируемый этим антионкогеном, локализован в ядре и является транскрипционным фактором, который включает ряд генов.
В норме антионкоген р53 (его продукт – белок р53) препятствует вхождению в S-фазу клеток с поврежденной или измененной ДНК, поддерживая таким образом целостность клеточного генома («страж генома»). Эту функцию он реализует двумя способами:
• временно задерживая клетку в G1-фазе цикла, давая ей возможность исправить повреждения ДНК прежде, чем клетка вступит в S-фазу;
• запускает механизм апоптоза в случаях, когда повреждения ДНК не подлежат исправлению.
Благодаря апоптозу исключается возможность передачи поломок ДНК в поколениях клеток. В случае нарушения этой функции р53 происходит накопление клеток с различными хромосомными повреждениями, что является характерным для клеток опухолей.
Мутации антионкогена р53 выявляются примерно в 60% злокачественных опухолей у человека. У людей с врожденной мутацией одного из аллелей р53 опухоли обнаруживаются в молодом возрасте с вероятностью 100% – семейный синдром Ли-Фраумени (редкое заболевание, проявляется: опухоли мозга, саркомы, лейкозы, рак молочных желез).
Антионкоген р53 во многом определяет реакции опухоли на химио- или лучевую терапию. В тех опухолях, где р53 не изменен и нормально функционирует, повреждение ДНК под влиянием химиотерапии или облучения вызывает апоптоз опухолевых клеток.
В опухолях с инактивированным р53 индуцированные повреждения ДНК не приводят к апоптозу, и такие опухоли резистентны к химио- и лучевой терапии.
Таким образом, для появления опухоли необходимо, чтобы в одной и той же клетке возникли мутации в нескольких разных протоонкогенах (с превращением их в онкогены) и антионкогенах. Следствием этих генетических изменений является утрата контроля над клеточной пролиферацией. В итоге клетка приобретает трансформированный фенотип – превращается в опухолевую клетку.
Стадийность опухолевого процесса. Предполагается, что опухоль развивается из единичной клетки, которая в процессе роста опухоли проходит ряд стадий (рис. 4).
I стадии – инициация. Инициация заключается в мутации одного из генов, регулирующих клеточное деление. Клетка становится инициированной, т.е. потенциально способной к неограниченному делению, но требующей для проявления этой способности дополнительных условий. Инициирующими факторами являются различные канцерогены, вызывающие повреждение ДНК.
II стадия – промоция. К промоторам относятся химические вещества (например, фенол, скипидар, карболовый эфир и др.), которые не вызывают повреждения ДНК, т.е. не являются канцерогенами, но при длительном воздействии на инициированные клетки способствуют возникновению опухоли.
Главное в промоции – стимуляция клеточного деления, что создает критическую массу инициированных клеток и способствует высвобождению их из-под тканевого контроля.

Рис. 4. Стадии опухолевого процесса
III стадии – прогрессия. Рост опухоли – это не только увеличение числа однородных клеток. Опухоль постоянно претерпевает качественные изменения и приобретает новые свойства – всё большую автономность от регулирующих воздействий организма, деструктивный рост, инвазивность, способность к образованию метастазов, приспособляемость к меняющимся условиям существования.
Опухоль является потомством, т.е. генерацией одной первичной клетки (моноклональная стадия), которая в результате трансформации приобрела способность нерегулируемого роста. Геном опухолевой клетки нестабилен, поэтому в процессе многократного деления появляются новые клоны, различающиеся генотипически и фенотипически (поликлональная стадия).
Это свойство определяет прогрессию опухоли, т.е. появление в результате естественного отбора клонов, обладающих быстрым ростом и устойчивостью к факторам защиты организма. Опухоль становится всё более агрессивной, автономной и устойчивой к лечебным воздействиям.
Таким образом, непрерывно прогрессируя, претерпевая качественные изменения, опухоль развивается в направлении увеличения злокачественности.
