
- •Термодинамический анализ физико-химических систем
- •Введение
- •1. Выбор варианта физико-химической системы
- •2. Основные представления химической термодинамики
- •2.1. Закон Гесса. Энтальпия химической реакции
- •2.2. Зависимость энтальпии химических реакций от температуры. Уравнение Кирхгофа
- •2.3. Изменение энтропии химической реакции
- •2.4. Изменение энергии Гиббса химической реакции
- •2.5. Расчет константы равновесия химической реакции
- •3.4. Задание 4. Термодинамический расчет константы равновесия химической реакции
- •4. Рекомендуемая литература
- •Образец титульного листа расчетной работы
- •Расчетная работа
2.4. Изменение энергии Гиббса химической реакции
Критерием самопроизвольного протекания химической реакции в неизолированной физико-химической системе для изобарных условий является изменение энергии Гиббса реакции Gреак.. Изменение энергии Гиббса термодинамической системы выражается формулой:
G = H - Т ·S, (13)
где S – изменение энтропии, Т – абсолютная температура.
Самопроизвольное возрастание энтропии S, сопровождающее приближение системы к равновесию, характеризуется переходом энтальпии H из концентрированной формы - энергии Гиббса G, в рассеянную форму - Т·S. Энергия Гиббса является функцией состояния системы, определяющей величину той части энтальпии, которая еще не рассеялась и за счет которой система еще может совершать работу. Таким образом, в самопроизвольных процессах энергия Гиббса убывает (G < 0) (рисунок 4). При достижении равновесия она принимает минимальное значение (G = Gmin), а ее приращение обращается в ноль (G = 0).

Рисунок 4. Направления изменения энергии Гиббса
в неизолированной системе
Для температуры 298 К в соответствие с уравнением (13) получим уравнение для расчета изменения энергии Гиббса химической реакции
G°298 = H°298 - 298 ·S°298, (14)
для других температур G°Т определяется аналогично.
Термодинамический анализ возможности протекания химической реакции в неизолированных системах в изотермических условиях, таким образом, состоит в определении величины и знака изменения энергии Гиббса реакции - G°реак (рисунок 4). При G°реак< 0 возможно самопроизвольное протекание реакции, при G°реак= 0 реакция находится в состоянии равновесия, а при G°реак > 0 самопроизвольное протекание реакции запрещено. В последнем случае возникает необходимость в оценке той температуры, при которой G°реак= 0 и, выше которой G°реак.< 0 , т.е. создается возможность самопроизвольного протекания реакции. Возможность такого расчета иллюстрируется схемой, представленной на рисунке 5, на которой показана типичная для большинства реакций линейная зависимость G°реак. от температуры (13). Ее расчет проводится из выражения (13):
G° = 0= H°Т – Тнач.реакции ·S°Т, откуда получаем
Тнач.реакции = HТ/SТ. (15)

Рисунок 5. Схема определения температуры начала реакции
Как видно из рисунка 5 температуру, при которой G°реак= 0 называют температурой начала реакции – Тнач.реакции, несмотря на то, что при этой температуре никакая химическая реакция невозможна. Для ее реального протекания необходимо G°реак.< 0, но особый физический смысл этой температуры очевиден.
2.5. Расчет константы равновесия химической реакции
Достижение в физико-химической системе термодинамического равновесия характеризуется, в частности, состоянием химического равновесия, когда скорость прямой реакции равна скорости обратной реакции. Поэтому для процесса аА + bВ eE + dD, протекающего при Р и Т = const будут неизменными и отношения:
 и
и
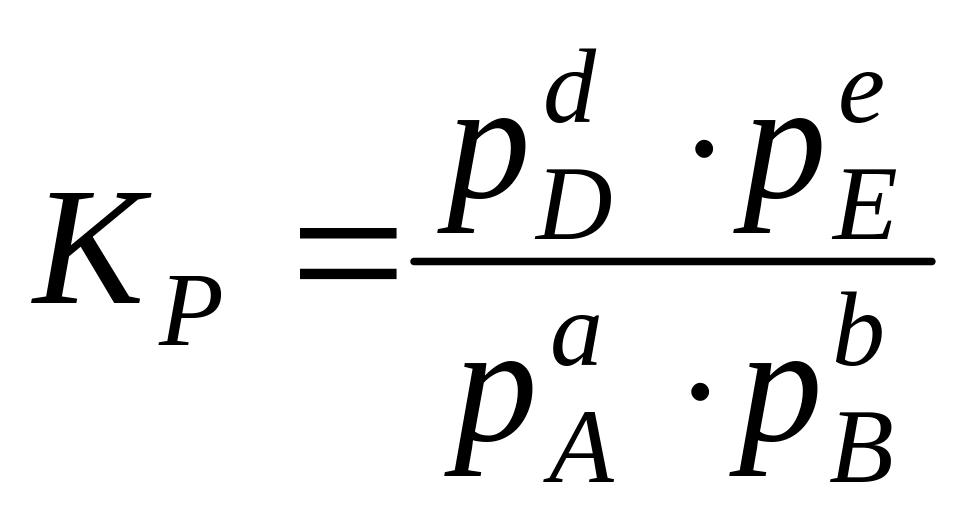 ,
,
где Сi и pi – соответственно равновесные концентрации и парциальные давления. Константа равновесия не зависит ни от давления, ни от концентрации, а определяется только природой реагирующих веществ и температурой.
Чем значительнее убыль энергии Гиббса, тем больше величина константы равновесия. Математически эта связь выражается зависимостью:
G°Т = - R·T·ln K, (16)
позволяющей по величине G°Т вычислить К.
3. Содержание расчетной работы
3.1. Задание 1. Термодинамический расчет
теплового эффекта химической реакции
Необходимо рассчитать для Вашего варианта физико-химической системы значения энтальпий химической реакции (в Дж/моль) при 298 К и заданной температуре, а также определить тепловой эффект химической реакции (в Дж) - количество выделенной или поглощенной энергии с учетом числа молей, участвовавших в реакции (определить по количеству указанного вещества).
3.2. Задание 2. Расчет изменения энтропии химической реакции
Необходимо по уравнениям (10) – (12), приведенным в разделе 2.3, рассчитать изменение энтропии при протекании в Вашей физико-химической системе химической реакции при 298 К и при заданной температуре.
3.3. Задание 3. Расчет изменения энергии Гиббса
химической реакции
Используя полученные в предыдущих заданиях значения энтальпии и изменения энтропии химической реакции определить величины изменения энергии Гиббса при 298 К и при заданной температуре и сделать выводы о возможности протекания химической реакции в указанных условиях. В случае невозможности химического взаимодействия в Вашей физико-химической системе при каких-либо условиях, необходимо оценить величину температуры начала реакции по уравнению (15) и сделать физически оправданный вывод.
