
Смещение химического равновесия
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
Величина константы химического равновесия-
Химическое равновесие является динамическим – число частиц, образующихся в еденицу времени при прямой реакции, равно числу частиц, ступивших во взаимодействие при обратной реакции.
Принцип Ле Шателье — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
15.Растворимость и произведение растворимости.
Раствори́мость — способность в-ва образовывать с другими в-вами однородные системы — растворы, в которых в-во находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого в-ва в его насыщенном р-ре либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от t и P. Растворимость жидких и твёрдых веществ — от t.
Произведение растворимости— произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении ( величина постоянная).В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.( Значения произведений растворимости приведены в справочниках).
16.Водные растворы электролитов и неэлектролитов. Диссоциация. Слабые и сильные электролиты.
Электроли́ты -растворы которые проводят электрический ток вследствие диссоциации на ионы.
Вещества, растворяющиеся в воде, но не распадающиеся на ионы (то есть находящие в растворе в молекулярном состоянии), называются неэлектролитами (пример — сахар).
Электролитическая диссоциация — распад молекул электролита в растворе с образованием (+) и (-)заряженных ионов — катионов и анионов.
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
17.Равновесия в растворах слабых электролитов. Константа и степень диссоциации.
Степень диссоциации (а) - отношение числа молекул, распавшихся на ионы (n'), к общему числу растворенных молекул (п):
![]()
(а) может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация),выражается в % .Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
Константа диссоциации является более точной характеристикой диссоциации электролита, которая от концентрации раствора не зависит.
уравнение реакции диссоциации электролита АК в общем виде:A K « A- + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как
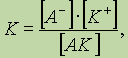
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
18.Сложные равновесия в растворах. Буферные растворы.
Буферные
растворы-растворы
с определённой устойчивой концентрацией
водородных ионов; смесь слабой кислоты
и её соли (напр., СН3СООН и CH3COONa) или
слабого основания и его соли (напр., NH3
и NH4CI).Значение pH буферного р-ра можно
рассчитать по формуле: ,![]() ,где pK это отрицательный десятичный
логарифм от константы диссоциации.
,где pK это отрицательный десятичный
логарифм от константы диссоциации.
19.Водородный показатель pH. Ионное произведение воды. Определение величины pH.
pH-мера
активности ионов водорода в растворе,
и количественно выражающая его
кислотность, вычисляется как отрицательный
десятичный логарифм активности
водородных ионов, выраженной в молях
на литр:
![]()
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Константу диссоциации воды можно вычислить по формуле:
![]() где:
где:
[H+] — концентрация ионов гидроксония (протонов);[OH−] — концентрация гидроксид-ионов;[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При
25 °C
константа диссоциации воды равна
1,8×10−16моль/л. Уравнение (1) можно переписать
как:,
![]()
20.Дисперсные системы.
Диспе́рсная систе́ма — это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда)
Основные типы дисперсных систем. По дисперсности, т. е. размеру частиц дисперсной условно делят на грубодисперсные и тонко(высоко)дисперсные. наз. коллоидно-дисперсными или просто коллоидными системами. В грубодисперсных системах частицы имеют размеры от 1 мкм и выше (уд. пов-сть не более 1 м2/г), в коллоидных - от 1 нм до 1 мкм (уд. пов-сть достигает сотен м2/г). Дисперсность оценивают по усредненному показателю (среднему размеру частиц, уд. пов-сти) или дисперсному составу.
21.Окислительно-восстановительные реакции.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
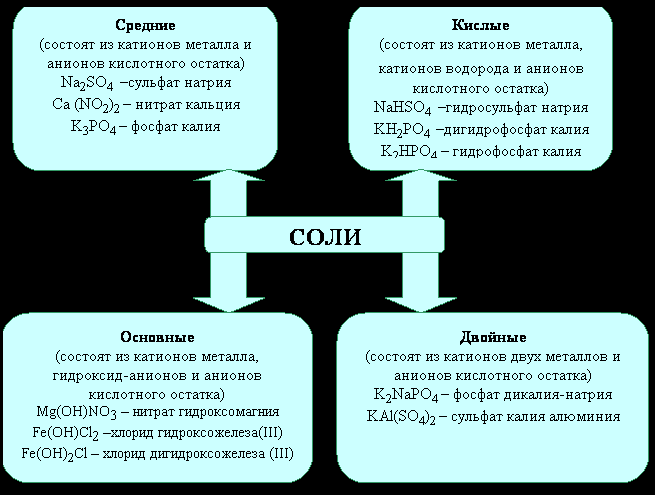
22.Основные классы неорганических соединении.Соли:основные,кислые,средние.
Неорганические в-ва:
простые-Ме и неМе
сложные-оксиды,основания,кисоты, соли
Соли-класс химических соединений, к которому относятся вещества, состоящие из катионов металла и анионов кислотного остатка.
23. Переходные элементы-d-элементы располагаются в побочных подгруппах период.системы.
На внешней эл.оболочке- 2,1,иногда 0 электронов, имеют (+) степень окисления ,выступают в кач-ве характерных Ме, проявляя сходство с Ме главных подгрупп.
Непереходные элементы-p-элементы. Характерно образование полярных связей.
