
- •Атомно-молекулярное учение
- •2.10.1. Расчет относительных и абсолютных масс атомов и молекул
- •4) Строение атома
- •6.3. Атом водорода. Линейчатые спектры
- •Экспериментальное подтверждение гипотезы де Бройля. Опыт Дэвиссона и Джермера.
- •Дифракция электронов на двух щелях
- •Содержание
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах[править | править исходный текст]
- •Взаимодействие ионов
- •Ионные радиусы
- •Энергия ионной связи
- •Ковалентная химическая связь
- •Виды гибридизации[править | править исходный текст]
- •Межмолекулярная и внутримолекулярная водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Силы межмолекулярного взаимодействия
- •Недостатки существующей классификации термодинамических систем
- •Внутренняя энергия и энтальпия
- •Закон Гесса[править | править исходный текст]
- •4. Энергия Гиббса. (g).
- •5. Химический потенциал ().
- •Второй закон термодинамики. Направление химических процессов.
- •[ Лед ] ↔ {вода} ↔ (пар)
- •Первый закон Рауля
- •Отклонения от закона Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Свойства разбавленных растворов неэлектролитов
- •Понижение давления пара над раствором
- •Температура кипения и замерзания
- •Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей
- •Основные положения теории Аррениуса.
- •Диссоциация солей, кислот и оснований
- •Классификация
- •2.Сильные и слабые электролиты. Константа диссоциации.
- •3.Закон разбавления Оствальда.
- •Изображение реакций ионного обмена
- •Правила написания реакций ионного обмена
- •Окислительно-восстановительные реакции подразделяют на межмолекулярные, внутримолекулярные, диспропорционирования (или самоокисления-самовосстановления), конпропорционирования.
- •Измерение потенциалов
- •Способы устранения омической составляющей при измерении
- •Основные факторы, влияющие на потенциал
- •Вывод уравнения Нернста
- •Применение электролиза в технике
- •Формулировка законов
- •Математический вид
- •Электрохимическая коррозия
- •Коррозия оцинкованного и луженого железа при местном повреждении
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
ПРИЧИНАМИ ВОЗНИКНОВЕНИЯ ГАЛЬВАНОПАР МОГУТ СЛУЖИТЬ, НАПРИМЕР: КОНТАКТ ДВУХ МЕТАЛЛОВ, СОПРИКАСАЮЩИХСЯ С РАСТВОРОМ ЭЛЕКТРОЛИТА, ПРИМЕСИ В МЕТАЛЛАХ, КОНТАКТ МЕТАЛЛА С ЕГО ОКСИДОМ, ЭЛЕКТРОХИМИЧЕСКАЯ НЕОДНОРОДНОСТЬ ПОВЕРХНОСТИ МЕТАЛЛА И ДР.
Коррозия – процесс самопроизвольного разрушения материалов в результате взаимодействия с окружающей средой.
Коррозия металлов подразделяется на химическую и электрохимическую. Химическая коррозия имеет место в средах, не проводящих электрический ток, и состоит в прямом химическом взаимодействии металла с реагентами окружающей среды.
Электрохимическая коррозия протекает в проводящих средах и включает в себя анодные и катодные процессы. Электрохимическая коррозия может протекать не только в среде растворов электролитов, но в среде влажного воздуха.
Механизм: Поверхность металла, находящегося во влажном воздухе, адсорбирует влагу из атмосферы и покрывается тонкой пленкой воды, содержащей атмосферные газы (О2, СО2, SO2 и др.) и, следовательно, обладающей заметной ионной проводимостью. Ионы металла переходят в раствор, образуется двойной электрический слой, и разность потенциалов. Если в контакте находятся два различных металла, то возникает гальванический элемент, работа которого проводит к разрушению материала анода. Роль второго металла могут выполнять микрокристаллы примесей, содержащихся в основном металле. Так, железо и его сплавы практически всегда содержат различные соединения железа с углеродом (например, Fe3C – цементит). Кристаллы железа исполняют роль анода, на котором протекает реакция:
Fe – 2e- → Fe2+,
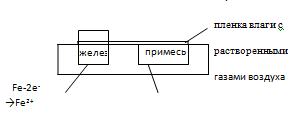
а кристаллы цементита – роль катода, на котором идет процесс восстановления растворенного кислорода воздуха:
О2 + Н2О + 4е- → 4ОН-
Далее возможно протекание побочных процессов:
Fe2+ +2OH- → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Микроскопические кристаллы железа и примесей образуют огромное количество гальванических элементов, работа которых будет сопровождаться разрушением металла и образованием ржавчины xFeO.yFe2O3.zH2O. Рыхлый слой ржавчины не предохраняет металл от дальнейшей коррозии, и процесс идет до полного разрушения материала.
|
Реакция восстановления кислорода протекает по приведенной выше схеме в щелочной или нейтральной среде. В кислой среде:
О2 + 4Н+ + 4е-→ 2Н2О
и выделение водорода
2Н+ + 2е- → Н2
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозий с выделением водорода или коррозией с водородной деполяризацией.
Условия, способствующие электрохимической коррозии.
1. Положение металла в ряду активности металлов: чем они дальше расположены друг от друга, тем быстрее происходит коррозия.
2. Чистота металла: примеси ускоряют коррозию.
3.Неровности поверхности металла, трещины.
4.Грунтовые воды, морская вода, среда электролита.
5.Повышение температуры.
6.Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Коррозия металлов иногда сопровождается образованием тонкой и плотной пленки соединений, защищающей его от дальнейшего разрушения. Это явление носит название пассивации и характерно для алюминия, хрома, кадмия, титана и др. Вещества, благоприятствующие образованию защитной пленки, носят название пассиваторов. Например, фосфорная кислота, гидрофосфаты, серная кислота с концентрацией выше 93% являются пассиваторами железа.
Напротив, вещества, ускоряющие коррозию, называются активаторами коррозии, например хлорид-ионы являются активаторами коррозии железа.
42)
42
