
- •Атомно-молекулярное учение
- •2.10.1. Расчет относительных и абсолютных масс атомов и молекул
- •4) Строение атома
- •6.3. Атом водорода. Линейчатые спектры
- •Экспериментальное подтверждение гипотезы де Бройля. Опыт Дэвиссона и Джермера.
- •Дифракция электронов на двух щелях
- •Содержание
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах[править | править исходный текст]
- •Взаимодействие ионов
- •Ионные радиусы
- •Энергия ионной связи
- •Ковалентная химическая связь
- •Виды гибридизации[править | править исходный текст]
- •Межмолекулярная и внутримолекулярная водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Силы межмолекулярного взаимодействия
- •Недостатки существующей классификации термодинамических систем
- •Внутренняя энергия и энтальпия
- •Закон Гесса[править | править исходный текст]
- •4. Энергия Гиббса. (g).
- •5. Химический потенциал ().
- •Второй закон термодинамики. Направление химических процессов.
- •[ Лед ] ↔ {вода} ↔ (пар)
- •Первый закон Рауля
- •Отклонения от закона Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Свойства разбавленных растворов неэлектролитов
- •Понижение давления пара над раствором
- •Температура кипения и замерзания
- •Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей
- •Основные положения теории Аррениуса.
- •Диссоциация солей, кислот и оснований
- •Классификация
- •2.Сильные и слабые электролиты. Константа диссоциации.
- •3.Закон разбавления Оствальда.
- •Изображение реакций ионного обмена
- •Правила написания реакций ионного обмена
- •Окислительно-восстановительные реакции подразделяют на межмолекулярные, внутримолекулярные, диспропорционирования (или самоокисления-самовосстановления), конпропорционирования.
- •Измерение потенциалов
- •Способы устранения омической составляющей при измерении
- •Основные факторы, влияющие на потенциал
- •Вывод уравнения Нернста
- •Применение электролиза в технике
- •Формулировка законов
- •Математический вид
- •Электрохимическая коррозия
- •Коррозия оцинкованного и луженого железа при местном повреждении
3.Закон разбавления Оствальда.
С изменением концентрации слабого электролита его степень диссоциации изменяется таким образом, что значение константы диссоциации остается постоянным.
Математически зависимость между степенью диссоциации, константой диссоциации и концентрацией раствора выражается законом разбавления Оствальда.
Пусть некоторая слабая кислота НА диссоциирует по схеме:
НАН+ + А-
НА - молярная концентрация (См) электролита в растворе.
Н+ = См ∙ - молярная концентрация ионов водорода.
Н+ = А- = См ∙
См ∙ (1-) - концентрация недиссоциированных молекул.
Н+А- См ∙ ∙ См∙ 2 ∙ См
Кд = НА = См(1-) = (1-)
При значениях 1 выражение упрощается:
Кдисс = 2 ∙ См
Из данного выражения видно, что при разбавлении раствора, т.е. при уменьшении его концентрации (См) степень диссоциации возрастает.
Закон Оствальда:
С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает.
Зная характеристики и Кдисс можно рассчитать концентрацию ионов в растворах электролитов:
См иона = См эл-та∙ ∙ n
для сильного электролита = 1, поэтому
См иона = См эл-та∙ n
для слабого электролита = √ Кдисс/См, поэтому
См иона = √ См эл-та∙ Кдисс ∙ n,
где n – число ионов данного типа, образовавшихся при диссоциации одной молекулы электролита.
Принципиальное
отличие сильных электролитов от слабых
состоит в том, что равновесие диссоциации
сильных электролитов полностью смещено
вправо:
![]()
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно,
что при электростатическом взаимодействии
ионов противоположных знаков необходимо
учитывать влияние ионной атмосферы.
При движении катиона в электростатическом
поле ионная атмосфера деформируется;
она сгущается перед ним и разрежается
позади него. Эта асимметрия ионной
атмосферы оказывает тем более тормозящее
действие движению катиона, чем выше
концентрация электролитов и чем больше
заряд ионов. В этих системах само понятие
концентрации становится неоднозначиным
и должно заменяться активностью. Для
бинарного одно-однозарядного электролита
KatAn → Kat+ + An+ активности
катиона (a+) и аниона (a–)
соответственно равны
![]()
где C+ и C– – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить
активности каждого иона в отдельности
невозможно, поэтому для одно-однозарядных
электролитов пользуются средними
геометрическими значений активностей
и коэффициентов активностей:
![]()
![]()
Коэффициент активности по Дебаю–Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для
данного электролита ионная сила
выражается уравнением Дебая–Хюккеля:
![]()
Ионная
сила в свою очередь равна
![]()
Здесь C – аналитическая концентрация, z – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
Н а
рис. 6.6 сопоставляются вычисленные и
экспериментальные значения lg γ±
при различных ионных силах. Из него
видно, что уравнение Дебая–Хюккеля
выполняется только для разбавленных
растворов.
а
рис. 6.6 сопоставляются вычисленные и
экспериментальные значения lg γ±
при различных ионных силах. Из него
видно, что уравнение Дебая–Хюккеля
выполняется только для разбавленных
растворов.
Зависимость
![]()
Пунктирные прямые рассчитаны по уравнению Дебая–Хюккеля. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов.
29)
29
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−илиH2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
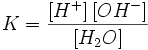
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При
25 °C константа диссоциации воды равна
1,8Ч10−16моль/л. Уравнение (1) можно переписать
как:
![]() Обозначим
произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56
моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Обозначим
произведение K·[H2O] = Kв = 1,8Ч10−16 моль/л·55,56
моль/л = 10−14мольІ/лІ = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так
как Kв — константа, при добавлении к
раствору кислоты (ионов H+), концентрация
гидроксид-ионов OH− будет падать и
наоборот. В нейтральной среде [H+] = [OH−]
=
![]() моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
Электролитическая диссоциация воды. Водородный показатель рН
Вода представляет собой слабый амфотерный электролит:
Н2О Н+ + ОН-или, более точно:2Н2О Н3О+ + ОН-
Константа
диссоциации воды при 25оС равна:
![]() Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
Такое
значение константы соответствует
диссоциации одной из ста миллионов
молекул воды, поэтому концентрацию воды
можно считать постоянной и равной 55,55
моль/л (плотность воды 1000 г/л, масса 1 л
1000 г, количество вещества воды
1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л = 55,55
моль/л). Тогда
![]()
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
![]()
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13.
В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой:
[H+] = [OH-] = 10-7 моль/л Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными. Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10-14. Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H+] = 10-3 моль/л, то [OH-] = KW/[H+] = 10-14/10-3 = 10-11 моль/л, или, если [OH-] = 10-2 моль/л, то [H+] = KW/[OH-] = 10-14/10-2 = 10-12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
рОН = - lg[OH-]
Легко показать, прологарифмировав ионное произведение воды, что
рН + рОН = 14
Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила. Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. По величине электропроводности чистой воды можно определить концентрацию ионов водорода и гидроксид-ионов в воде.
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул в воде практически равна общей концентрации воды, поэтому из выражения для константы диссоциации воды получакм, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными. В кисдых растворах больше ионов водорода, в щелочных - гидроксид-ионов. Но произведение их концентраций всегда постоянно. Это означает, что если известна концентрация ионов водорода в водном растворе, то тем самым и определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Кислотность или щёлочность раствора можно выразить более удобным способом: вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается рН:. Отсюда ясно, что в нейтральном растворе pH=7; в кислых растворах рН<7 и тем меньше, чем кислее раствор; в щелочных растворах рН>7, и тем больше, чем больше щёлочность раствора.
Для измерения рН существуют различные методы. Приближённо реакцию раствора можно определить с помощью специальных реакторов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространены метиловый оранжевый, метиловый красный, фенолфталеин и лакмус.
Кислые растворы всегда характеризуются значениями рН меньше 7 (табл. 8.4).
рН= [H3O+] [ОН-]
Понятие о водородном показателе растворов рН ввел датский биохимнк С. П. Соренсен (1868-1939), разрабатывавший в это время способы улучшения контроля за качеством пива. Соренсен известен также своими исследованиями физических свойств белков и разработкой аналитических методов их определения. Соренсену и его жене удалось впервые получить в кристаллической форме белок яичного альбумина.
Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. Простейший буферный раствор - это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl). С точки зрения протонной теории, кислотой называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов. буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа: Воснование + Н+ ВН+сопряженная кислота НАкислота Н+ + А-сопряженное основание Сопряженные кислотно-основные пары В /ВН+ и А- /НА называют буферными системами. Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство рН биологических жидкостей, тканей и органов - кислотно-основной гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей.
Значение
pH буферного раствора можно рассчитать
по формуле:
![]() ,
где
,
где
![]() это
отрицательный десятичный логарифм
от константы диссоциации кислоты
это
отрицательный десятичный логарифм
от константы диссоциации кислоты
![]() .
.
По
сути
![]() .
.
30)
30
В растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
BaSO4(осадок) <=> Ba2+ (раствор) + SO42- (раствор)
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса выразится следующим уравнением:
K = aBa2+ · aSO42- / aBaSO4
Так как активность твердого сульфата бария, есть величина постоянная, то и произведение активностей ионов также представляет собой постоянную величину.
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе, есть величина постоянная при данной температуре и называется произведением растворимости (ПР). Для вещества состава AnBm произведение растворимости вычисляется по формуле:
ПР = (aAz+)n · (aBx-)m , где:
aAz+ - коэффициент активности иона Az+;
aBx- - коэффициент активности иона Bx-.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности ионов мало отличаются от единицы. В подобных случаях произведение активностей ионов в выражении для вычисления ПР можно заменить произведением их концентраций и формула расчета произведения растворимости для вещества состава AnBm может быть записана в виде:
ПР = [Az+]n · [Bx-]m , где:
[Az+] - концентрация иона Az+;
[Bx-] - концентрация иона Bx-.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Напротив, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. Добавление в раствор электролита, не имеющего общих ионов с малорастворимым, приводит к увеличению растворимости малорастворимого электролита за счет увеличения ионой силы раствора (так называемый солевой эффект).
Между значениями ПР как константы гетерогенного ионного равновесия и изменением энергии Гиббса существует зависимость, определяемая уравнением:
ΔG = - RTln(ПР)
Так как значения ПР обычно очень малы, часто используется показатель произведения растворимости pПР = -lg(ПР).
Величина ПР меняется в зависимости от температуры.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа
этого равновесия рассчитывается по
уравнению:
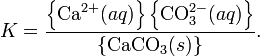
В
приближении идеального
раствора с учётом того, что
активность
чистого компонента равна единице,
уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Образование осадка малорастворимого сильного электролита МxАy произойдет только тогда, когда после смешивания растворов реагентов в конечном объеме смеси будет соблюдаться соотношение (сMy+)x · (сАx−)y > ПР(MxAy)
где в круглых скобках стоят выбранные (по условию проведения опыта) молярные концентрации катионов и анионов в конечном растворе (после смешивания растворов реагентов).
Если условие выпадения осадка не выполняется,
т.е. (сMy+)x · (сАx−)y < ПР(MxAy ), то образование осадка происходить не будет.
31)
31
Насыщенный раствор находится в равновесии с твердой фазой
растворяемого вещества. Гетерогенное равновесие «осадок ⇌насыщенный
раствор» характеризует константа равновесия. Если малорастворимый
электролит диссоциирует по уравнению AmBn ⇌mAn+ + nBm-
то выражение для константы равновесия – произведения растворимости
(ПРAmBn) – будет иметь вид: Кр = ПР AmBn = [An+]m∙[Bm-]n, где [An+], [Bm-] –
молярные концентрации ионов An+ и Bm- соответственно, в насыщенном
растворе. Например, для равновесия: СaSO4⇌ Ca2+ + SO4
2–
ПР CaSO4=[Ca 2+] [SO42- ] =3,72·10-5 [моль2/л2] (при 25оС)
Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре, и называемая произведением растворимости.
Зная произведение растворимости (ПР), можно вычислить растворимость вещества (S) при данных условиях, т.е. концентрацию насыщенного раствора в [моль/л] и в [г/л]. Например, для бинарных электролитов (ВaSO4, СaСO3, AgI и др.) растворимость [моль/л] численно равна: S = ПР .
В ненасыщенном растворе возможно растворение дополнительного
количества вещества, так как концентрация меньше, чем в насыщенном. Из
перенасыщенного раствора осадок образуется, так как его концентрация
больше, чем в насыщенном.
Отсюда вытекают условия образования и растворения осадка:
1) если [An+]m∙[Bm-]n = ПРAmBn, то осадок находится в равновесии с
раствором (насыщенный раствор);
2) если [An+]m∙[Bm-]n > ПРAmBn, то осадок выпадает (перенасыщенный
раствор);
3) если [An+]m∙[Bm-]n < ПРAmBn, то осадок растворяется (ненасыщенный
раствор).
Важным следствием является правило, используемое для более полного
удаления из раствора какого-либо иона: растворимость малорастворимого
электролита уменьшается при введении хорошо растворимого электролита,
имеющего одноименный (общий) ион с малорастворимым электролитом.
В водных растворах электролитов химические реакции протекают с
участием ионов, такие реакции называются ионно-обменными, а уравнения
этих реакций – ионными уравнениями.
В ионных уравнениях реакций формулы сильных электролитов
записываются в виде ионов, формулы слабых электролитов, осадков и газов – в виде молекул.
Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита.
1. Образование малорастворимого соединения, выпадающего в виде осадка: AgNO3 + NaCl = AgCl↓ + NaNO3 (молекулярное уравнение)
Ag+ + NO3 – + Na+ + Cl – = AgCl↓ + Na+ + NO3 – (полное ионное уравнение)
Ag+ + Cl – = AgCl↓ (сокращенное ионное уравнение ).
2. Образование газообразного вещества, удаляемого из раствора:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2↑
CO32 – + 2H+ = H2O + CO2↑
3. Образование растворимого, но мало диссоциированного вещества, например, воды, слабой кислоты или слабого основания:
CH3COONa + H2SO4 = Na2SO4 + CH3COOH
CH3COO –+ Na+ = 2Na+ +SO42 –+ CH3COOH
CH3COO – + H+ = CH3COOH;
4. Образование устойчивой комплексной частицы – молекулы или иона:
HgI2 + 2KI = K2[HgI4]
Hg2+ + 2I – + 2K+ + 2I – = 2K+ + [HgI4]2 –
Hg2+ + 4I – = [HgI4]2 –
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуются соль и вода, например: NaOH + HCl = NaCl + H2O или OH – + H+ = H2O.
При нейтрализации сильного основания сильной кислотой равновесие практически полностью смещено в сторону образования воды. Реакции нейтрализации при взаимодействии кислот и оснований, различающихся по силе, не доходят до конца вследствие протекания обратной реакции гидролиза соли, например: СН3СООН + NaOH ⇌CH3COONa + Н2О
СН3СООН + ОН-⇌СН3СОО- + Н2О.
Реакции нейтрализации экзотермические и протекают с выделением тепла.
Гидролиз солей - это ионно-обменное взаимодействие соли с водой. Реакция протекает, если в продуктах образуется слабая кислота и/или слабое основание. Она основана на поляризующем действии ионов соли на молекулы воды, в результате которого нарушается равновесие диссоциации воды: Н2О ⇌ Н+ + ОН-. Гидролиз - это реакция обратная нейтрализации, и идёт, следовательно, с поглощением тепла, то есть гидролиз эндотермический процесс.
Соли, образованные сильными основаниями и сильными кислотами (NаСl, КNO3, Rb2SO4), не содержат ионов, способных к взаимодействию с водой, поэтому гидролизу не подвергаются. Реакция среды в растворе таких солей нейтральная (рH=7).
Гидролиз по катиону характеризует соли, образованные сильной кислотой и слабым основанием (NH4Cl, ZnSO4, Al(NO3)3). В результате катион соли связывает ионы ОН- из воды. В растворе увеличивается концентрация ионов Н+ и реакция среды становится кислой (рH<7).Например:
NH4+ + HOH⇌ NH4OH + H+ (уравнение в краткой ионной форме)
NH4Cl + HOH⇌ NH4OH + HCl (полное молекулярное уравнение)
Количественно гидролиз характеризуется константой гидролиза (Кг) и степенью гидролиза (h). Константа гидролиза соли сильной кислоты и слабого основания рассчитывается по формуле
Кг = [Кв ∕ Косн], где Кв – ионное произведение воды, Косн – константа диссоциации слабого основания.
Расчет рН в растворе соли слабого основания и сильной кислоты осуществляют по формуле
рН = 7 + ½ lgKосн - ½ lgСсоли, где Ссоли – молярная концентрация соли.
Гидролиз по аниону характеризует соли, образованные слабой кислотой и сильным основанием (NаF, Na2CO3, Rb3PO4). Анион соли связывает катион Н+ воды и в растворе накапливаются ионы ОН-, среда щелочная (рH > 7).
F- + H2O⇌ H+ + OH- (уравнение в краткой ионной форме)
NaF + HOH⇌ HF + NaOH (полное молекулярное уравнение)
Константа гидролиза соли сильного основания и слабой кислоты рассчитывается по формуле Кг=[Кв ∕ Ккисл], где Ккисл – константа диссоциации слабой кислоты.
Расчет рН в растворе соли сильного основания и слабой кислоты осуществляют по формуле рН = 7 - ½ lgKкисл + ½ lgСсоли.
Гидролиз по катиону и аниону протекает в растворах солей, образованных слабой кислотой и слабым основанием (NH4CN, NH4СH3COO). Реакция среды в растворах таких солей близка к нейтральной. Может быть слабокислой или слабощелочной и определяется способностью к диссоциации продуктов гидролиза: слабой кислоты и слабого основания.
NH4F + HOH⇌ NH4OH + HF (полное молекулярное уравнение)
Константа гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты: Кг = [Кв /(Ккисл∙Косн)].
Расчет рН в растворе соли слабого основания и слабой кислоты:
рН=7 - ½ lgKкисл + ½ lgКосн.
Соли, образованные слабым основанием и слабой кислотой (Al2S3, Cr2S3, Al2(СО3)3), могут подвергаться необратимому разложению водой, если в продуктах образуются осадки или выделяется газ. Водные растворы таких солей не существуют. Например: Al2S3 + 6 HOH⇌ 2 Al(ОН)3 + 3H2S↑
Степень гидролиза соли (h) - это отношение количества вещества соли, подвергшегося гидролизу, к общему количеству вещества соли. Константа гидролиза (Кг) и степень гидролиза (h) связаны соотношением
Кг=Ссоли.h2/(1-h), где Ссоли - молярная концентрация соли в растворе.
Если h<<1, то Кг = Ссоли.h2; h = Kr /Cсоли
Степень гидролиза соли определяется следующими факторами:
1.Так как гидролиз - процесс эндотермический, то повышение температуры усиливает гидролиз.
2. Чем слабее кислота и/или основание, образующиеся при гидролизе, тем выше степень гидролиза их солей.
3. Чем меньше молярная концентрация соли, тем степень гидролиза выше, т.е. с разбавлением гидролиз усиливается.
4. По принципу Ле-Шателье, добавление продуктов гидролиза его подавляет.
Буферный раствор - это раствор, содержащий равновесную систему, способную поддерживать практически постоянное значение рН при разбавлении или при добавлении небольших количеств кислоты или щелочи. Буферные растворы обладают амфотерными свойствами, взаимодействуют с сильными кислотами и основаниями. Их характеризуют рабочей областью рH и буферной емкостью.
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка.
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), малодиссоциирующее соединение (очень слабый электролит, в том числе и вода) или комплексное соединение. В таких случаях реакции будут практически не обратимы.
