
- •Атомно-молекулярное учение
- •2.10.1. Расчет относительных и абсолютных масс атомов и молекул
- •4) Строение атома
- •6.3. Атом водорода. Линейчатые спектры
- •Экспериментальное подтверждение гипотезы де Бройля. Опыт Дэвиссона и Джермера.
- •Дифракция электронов на двух щелях
- •Содержание
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах[править | править исходный текст]
- •Взаимодействие ионов
- •Ионные радиусы
- •Энергия ионной связи
- •Ковалентная химическая связь
- •Виды гибридизации[править | править исходный текст]
- •Межмолекулярная и внутримолекулярная водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Силы межмолекулярного взаимодействия
- •Недостатки существующей классификации термодинамических систем
- •Внутренняя энергия и энтальпия
- •Закон Гесса[править | править исходный текст]
- •4. Энергия Гиббса. (g).
- •5. Химический потенциал ().
- •Второй закон термодинамики. Направление химических процессов.
- •[ Лед ] ↔ {вода} ↔ (пар)
- •Первый закон Рауля
- •Отклонения от закона Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Свойства разбавленных растворов неэлектролитов
- •Понижение давления пара над раствором
- •Температура кипения и замерзания
- •Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей
- •Основные положения теории Аррениуса.
- •Диссоциация солей, кислот и оснований
- •Классификация
- •2.Сильные и слабые электролиты. Константа диссоциации.
- •3.Закон разбавления Оствальда.
- •Изображение реакций ионного обмена
- •Правила написания реакций ионного обмена
- •Окислительно-восстановительные реакции подразделяют на межмолекулярные, внутримолекулярные, диспропорционирования (или самоокисления-самовосстановления), конпропорционирования.
- •Измерение потенциалов
- •Способы устранения омической составляющей при измерении
- •Основные факторы, влияющие на потенциал
- •Вывод уравнения Нернста
- •Применение электролиза в технике
- •Формулировка законов
- •Математический вид
- •Электрохимическая коррозия
- •Коррозия оцинкованного и луженого железа при местном повреждении
Свойства разбавленных растворов неэлектролитов
Многие свойства растворов зависят от природы компонентов и от их концентрации. Однако некоторые физические свойства растворов неэлектролитов зависят только от концентрации частиц растворенного вещества и природы растворителя, но не зависят от индивидуальных свойств вещества. Такие свойства называются коллигативными. К их числу относятся: понижение давления пара над раствором; повышение температуры кипения и понижение температуры замерзания и осмотическое давление раствора. Количественно зависимость этих свойств от концентрации выражается законами Рауля и Вант-Гоффа.
Понижение давления пара над раствором
В результате естественного процесса испарения над любой жидкостью (растворителем или раствором) образуется пар
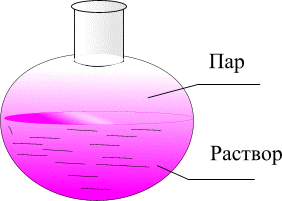
Рис.1 Схема равновесия двухфазной системы раствор - пар
Процесс испарения, то есть переход молекул из жидкости в газовую фазу осуществляется непрерывно. Но по мере увеличения числа молекул в газовой фазе возрастает вероятность того, что молекулы газовой фазы будут переходить в жидкость. Этот процесс называется конденсацией. В конце концов оба противоположно действующих процесса начинают идти с одинаковой скоростью и с этого момента давление в газовой фазе остается постоянным, т.е. система находится в состоянии динамического равновесия ( G = 0).
Если в равновесную систему введено нелетучее вещество, то его переход в паровую фазу исключен. При образовании раствора концентрация растворителя уменьшается, что вызывает нарушение равновесия. В соответствии с принципом Ле-Шателье начинает протекать процесс, стремящийся ослабить влияние этого воздействия, т.е. конденсация. В новом состоянии равновесия давление насыщенного пара растворителя становится меньше. Таким образом, давление пара над раствором всегда ниже, чем над чистым растворителем .
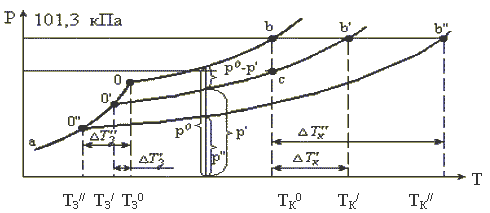
Рис.2 Температурная зависимость давления насыщенного пара для твердого и жидкого растворителя и растворов различной концентрации
Как видно из рисунка, кривая давления пара раствора лежит ниже кривой давления пара чистого растворителя, причем тем ниже, чем больше концентрация раствора. Количественное описание этого явления дает I закон Рауля:
"Относительное понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворенного вещества:"
![]() (1)
(1)
где Р - давление пара над раствором; P0 - давление пара чистого растворителя; Р = P0 - Р - относительное понижение давления пара;
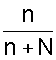
-
мольная доля
растворенного вещества (отношение числа
моль растворенного вещества к суммарному
числу моль всех компонентов).![]()
Температура кипения и замерзания
Вместе с изменением давления пара над раствором изменяются и температуры кипения и замерзания растворов по сравнению с чистым растворителем. Температуры кипения и замерзания - физические постоянные, однако иначе дело обстоит в растворах. Жидкость начинает кипеть, когда давление ее насыщенных паров достигает ее внешнего давления ( 101 кПа). Температура замерзания жидкости соответствует такой температуре, при которой уравниваются давления паров твердой и жидкой фаз (точки 0/ и 0// на рис.8. Поскольку давление паров над раствором всегда ниже, чем над чистым растворителем, раствор кипит при более высокой температуре, а замерзает при более низкой температуре, чем чистый растворитель
Согласно II закону Рауля:
tкип = Екип Сm; tзам = Kзам Сm , (2)
где tкип, tзам - повышение tкип раствора и понижение tзам раствора, соответственно. Екип и Кзам.- эбуллиоскопическая и криоскопическая константы растворителя зависят только от природы растворителя (см. таблицу приведенную ниже). Эбуллиоскопическая константа воды равна 0,52 С; это значит, что растворы, содержащие по 1 моль неэлектролита на 1000 г воды, кипели бы при 100,52 С, если бы эти растворы существовали и были бы идеальными (на самом деле такие концентрированные растворы, как одномоляльные, законам Рауля не подчиняются). Сm- моляльная концентрация раствора;
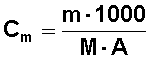 (3)
(3)
где m - масса растворенного вещества; M - молярная масса вещества; А - масса растворителя.
Таблица
